关于公开征求ICH指导原则《M7(R2):评估和控制药物中的DNA活性(致突变)杂质以限制潜在的致癌风险》意见的通知
发布时间:
2022-
01-
07
11:
26浏览次数:
ICH指导原则《M7(R2):评估和控制药物中的DNA活性(致突变)杂质以限制潜在的致癌风险》现进入第3阶段征求意见。按照ICH相关章程要求,ICH监管机构成员需收集本地区关于第2b阶段指导原则草案的意见并反馈ICH。
M7(R2)原文和中文译文见附件,现就该指导原则内容及中文译文翻译稿向社会公开征求意见。
社会各界如有意见,请于2022年2月15日前通过电子邮箱反馈我中心。
联系人:马磊、周植星
邮箱:mal@cde.org.cn;
zhouzhx@cde.org.cn
ICH工作办公室 2021年12月21日
评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险征求意见稿M7(R2)
原料药的合成涉及反应物、试剂、溶剂、催化剂和其它加工助剂的使用。因化学反应和终产物降解,原料药及制剂中会存在杂质。ICH Q3A(R2)《新原料药中的杂质》和Q3B(R2)《新药制剂中的杂质》(参考文献1、2)为大多数杂质的定性和控制提供了指导,但其对DNA反应性杂质的指导有限。本指导原则旨在提供一个用于致突变杂质的鉴别、分类、定性和控制的可行性框架方案,用于控制杂质潜在的致癌风险。本指导原则意在补充ICH Q3A(R2)、Q3B(R2)(注释1)和ICH M3(R2)《支持药物进行临床试验和上市的非临床安全性研究指导原则》(参考文献3)。本指导原则强调,为把致癌风险控制在可忽略的程度,制订致突变杂质的限度时,兼顾安全性和质量风险管理两方面。本指导原则对原料药或制剂中残留或可能残留的致突变杂质进行评估和控制,且考虑用药人群的具体情况提出了建议。本指导原则预期在新原料药和新制剂临床研究和后续上市申报阶段提供指导。它也适用于部分情形的已上市药品的上市后申请,以及在已上市制剂中使用的原料药用于新制剂时的上市申请,包括:•变更了原料药合成工艺,导致产生了新杂质或提高了已有杂质限度;•变更了处方、组分或生产工艺,导致产生了新降解产物或提高了已有降解产物限度;•变更了适应症或给药方案,显著影响了可接受的致癌风险水平。本指导原则所述对杂质潜在致突变性的评估不适用于以下类型的原料药和制剂:生物/生物技术制品、肽类、寡核苷酸、放射性药物、发酵产品、草药、动物或植物来源的粗制品。本指导原则不适用于ICH S9(参考文献4)所定义的拟用于晚期癌症适应症的原料药和制剂。另外,某些情况下拟用于其它适应症的原料药本身在治疗浓度下就存在遗传毒性,且预测可能会增加致癌风险。在这些情况下,暴露于致突变杂质不会显著增加原料药的致癌风险。因此,杂质可以按非致突变性杂质进行控制。本指导原则所述对杂质潜在致突变性的评估不适用于矫味剂、着色剂和香料,以及已上市药物中使用的辅料。本指导原则不适用于药物包材相关的可浸出物,但如有必要,可使用本指导原则中描述的限制潜在致癌风险的安全风险评估原则。如有必要,药品中首次使用的化学合成辅料中的杂质可使用本指导原则的安全风险评估原则。本指导原则关注焦点为较低水平即可直接造成DNA损伤,进而导致DNA突变,因此可能引发癌症的DNA反应性物质。这类致突变性致癌物通常由细菌回复突变(致突变性)试验检测确定。其它类型的非致突变性遗传毒性物质通常有阈值机制,以一般杂质水平存在时通常不会对人造成致癌风险。因此,为限制人暴露于潜在致突变杂质相关的患癌风险,使用细菌致突变试验来评估杂质致突变的可能性及控制的必要性。根据已有知识,基于结构的评估有助于预测细菌致突变试验结果。这种评估有多种方法,包括综述已有文献和/或计算机毒理学评估。本文采用了毒理学关注阈值(threshold of toxicological concerns, TTC)的概念。TTC定义了未经研究的化学物质在致癌或其他毒性作用风险可忽略时的可接受摄入量。确定TTC的方法总体上可认为是非常保守的,它是将50%肿瘤发生率(TD50)的剂量简单线性外推到百万分之一发生率而得出,且采用的TD50数据取自最敏感物种和对诱导最敏感的肿瘤发生部位。在使用TTC评估原料药和制剂中致突变杂质的可接受限度时,宜采用1.5 μg/天的杂质限度,对应理论上额外增加10-5的患癌风险。已确定有些结构基团具有较高的致癌性,即使摄入量低于TTC水平,理论上仍会具有高致癌风险。这类高效致突变致癌物,被称为“关注队列”,包括黄曲霉毒素类、N-亚硝基化合物,以及烷基-氧化偶氮基化合物。早期临床研究阶段由于整体研发经验有限,控制策略和控制方法可能不完善。本指导原则基于已建立的风险评估策略制订致突变杂质的可接受摄入量。在早期研发阶段,将可接受风险设定为理论计算患癌风险增加约为百万分之一。在研发后期及上市后,将可接受风险设定为理论计算患癌风险增加约为十万分之一。与人终生罹患各类癌症的概率(大于三分之一)相比,上述风险控制水平相当于仅造成理论上患癌风险的微小增加。需注意的是,现确立的癌症风险评估是基于终生暴露的情形建立的。在研发和上市期间短于终生(less than lifetime, LTL)的暴露时杂质可以有更高的可接受限度,并仍保持相同的风险水平。使用量化的患癌风险值(十万分之一),并将其转化为基于风险的剂量(TTC),是一种高度假设性的方法,不应作为实际风险的真实数值。尽管如此,TTC的概念为致突变性化合物提供了一个安全暴露量的估值。但是,考虑到推导TTC值时采用了保守的假设,超出TTC值并不一定会增加患癌风险。实际增加的癌症发生率远低于十万分之一。此外,如果致突变化合物在啮齿动物生物测定中显示为非致癌物,则预计致癌风险不会增加。基于上述这些原因,患者已暴露于某杂质,该杂质后来被鉴定为致突变的杂质时,患者的患癌风险不一定因此增加。应进行风险评估来决定是否需要采取进一步措施。如果确定某杂质具有潜在风险,则需根据对工艺的理解开发适当的控制策略,和/或根据开发分析控制方法,保证致突变杂质水平在可接受限度下,无致癌风险。某些情况下,某杂质同时也是原料药的代谢产物。此时对代谢产物的致突变风险评估可作为该杂质限度制订的依据。本指导原则初衷不是用于回顾性分析(即本指导原则采纳前已上市的药品)。但是,一些上市后变更需重新评估致突变杂质相关的安全性。本节内容适用于在本指导原则采纳之前或之后药品的上市后变更。第8.5节(生命周期管理)包含了本指导原则采纳后的上市药品的其它建议。原料药涉及CMC的上市后变更,对起始物料之后的部分如合成路线、试剂、溶剂或工艺条件的变更可能对致突变杂质的潜在风险产生影响,申报资料中应对这些影响进行评估。特别应评估变更是否会产生任何新的致突变杂质或提高已知致突变杂质的可接受限度。对不受变更影响的杂质建议不再重新评估。例如,如果只变更部分生产工艺,则致突变杂质的风险评估应局限于该变更是否会产生新的致突变杂质,在受影响的步骤中致突变杂质是否升高,以及来自上游步骤中的已知致突变杂质的水平是否升高。与这些变更相关的申报参照第9.2节内容。变更原料药、中间体或起始物料的生产场地,或变更原材料供应商,不需要重新评估致突变杂质风险。如拟提交一个新的原料药供应商,如有充分证据证明该供应商生产该原料药采用了与审评区域内已上市药品中所用的原料药相同的合成路线,则可以说明关于致突变杂质的风险/获益是可以接受的,不需要根据本指导原则进行评估。如果不是这种情况,则需要根据本指导原则进行评估。制剂的上市后变更(例如组分、生产工艺、剂型的变更),应包括对新致突变降解产物或提高已知致突变降解产物的可接受限度相关的潜在风险进行评估。必要时,申报资料应包括更新后的控制策略。如果制剂所用的原料药没有变化,则不建议也不要求对该原料药重新进行评估。制剂生产场地变更不需要重新评估致突变杂质风险。变更已上市药品的临床用途时,需重新评估致突变杂质限度的情形包括临床使用剂量的显著增加、服药时间的增加(特别是先前适应症将致突变杂质限度设定为高于终生使用时的可接受摄入量,但该摄入量可能已不再适合于更长给药周期的新适应症),或者适应症由病情较严重或危及生命的疾病改为不太严重的疾病,之前杂质可接受摄入量(第7.5节)较高,可能已不再适合新适应症。与新给药途径或扩大患者人群(包括孕妇和/或儿童)相关的已上市药品临床用途的变更,如日剂量或服药时间没有增加,则不需要重新评估致突变杂质风险。如有特殊担忧,本指导原则也可用于已上市的药品。除非杂质有“关注队列”(第3节)中的结构,否则仅凭杂质存在警示结构不足以启动后续措施。但是一种需关注的情形是,在已建立了上市所需总体控制策略和质量标准后,获得了新的相关杂质的危害性数据(分为第1类和/或2类,第6节)。这些新的相关杂质的危害性数据应来自符合相关法规、指导原则的高质量的科学研究,且可提供试验数据或报告。同样地,已上市药品中发现新的1类或2类致突变杂质,也属于一种需要关注的情形。上述两种情形下,一旦申请人知晓这些新的信息,即需要遵循本指导原则进行评估。应对新原料药合成和储藏期间以及新制剂生产和储藏期间实际产生的和潜在的杂质进行评估。•对可能出现在最终原料药的潜在杂质应该进行分析,以确定是否需要进一步评估其潜在致突变性。合成杂质和降解产物分别按照第5.1节和第5.2节描述的步骤遵照执行。实际杂质包括原料药中观察到的超出ICH Q3A报告限度的杂质。如果实际杂质水平超过了ICH Q3A中所述的鉴定阈值,则应进行鉴定。应当注意,有些低于鉴定限度的杂质可能也已经进行了鉴定。原料药中潜在杂质包括从起始原料到原料药的合成路线中的起始物料、试剂和中间体。应对杂质残留到原料药的风险进行评估,包括起始原料和中间体中已鉴定的杂质,以及合理预测从起始原料到原料药的合成路线中产生的副产物。由于有些杂质被带入原料药的风险可以忽略(例如,很长的合成路线中较早的合成步骤中的杂质),因此,可以在工艺某一个步骤之后进行潜在致突变性杂质的评估,并应提供确定这一步骤的风险依据。对于在原料药合成路线后期才引入的起始物料(并且其合成路线已知),应评估起始物料合成的最后几步中的潜在致突变杂质。结构已知的实际杂质和如上所述的潜在杂质应按第6节所述评估其潜在致突变性。原料药中实际的降解产物包括原料药在拟定的长期储藏条件下以及带内包装和外包装储藏期间观察到的超过ICH Q3A报告限度的降解产物。制剂中实际的降解产物包括制剂在拟定的长期储藏条件下以及带内包装和外包装储藏期间观察到的高于ICH Q3B报告限度的降解产物,还包括制剂生产过程中产生的杂质。如果实际降解产物水平超过ICH Q3A/Q3B所述的鉴定限度,则应进行鉴定。应当注意,有些低于鉴定限度的降解产物可能也已经被鉴定。原料药和制剂中潜在的降解产物是在长期储藏条件下预期可能会生成的杂质。潜在的降解产物包括加速稳定性研究中(例如,40°C/相对湿度75% 6个月)和ICH Q1B(参考文献5)所述的验证性光稳定性研究期间所生成且高于ICH Q3A/Q3B鉴定限度的杂质,但这些杂质在原料药和制剂带内包装长期储藏条件下尚未产生。降解途径的相关知识,例如化学降解原理、相关强制降解试验和研发期间的稳定性,可用来指导选择需评估的有致突变性的潜在降解产物。实际的和潜在的降解产物可能存在于最终的原料药或制剂中,并且在结构已知的情况下,应按照第6节所述评估致突变性。第5.1和第5.2节所述的杂质评估适用于临床研发中的产品。然而,众所周知,这一阶段可获得的信息是有限的。例如,在临床研发期间,可能无法获得长期稳定性和光照稳定性研究信息,因此关于潜在降解产物的信息可能很有限。此外,ICH Q3A/Q3B中列出的杂质限度并不适用于临床阶段的产品,因此此时鉴定出的杂质较少。危害性评估首先通过对数据库和文献的检索获得的杂质致癌性和细菌致突变数据对实际和潜在杂质进行初步分析,根据表1将其归为1类,2类或5类。如果无法获得这样的分类数据,则应进行预测细菌致突变性的构-效关系(SAR)评估。根据评估结果将杂质归为3类、4类或5类。
| | |
| | |
| 致癌性未知的已知致突变物(细菌致突变阳性*,但无啮齿动物致癌性数据) | |
| | 控制不超过可接受限度(适宜的TTC)或进行细菌致突变试验; |
| 有警示结构,且与经测试无致突变性的原料药及其相关化合物(例如,工艺中间体)具有相同的警示结构 | |
| 无警示结构,或虽有警示结构但有充分的数据证明无致突变性或无致癌性 | |
*或其它相关的阳性致突变性数据,这些数据可指示DNA反应活性相关的基因突变。(例如,体内基因突变研究显示阳性)计算机毒理学应采用(定量)构-效关系((Q)SAR)方法学进行毒性评估,目的是预测细菌致突变试验(参考文献6)的结果。应采用两种互补的(Q)SAR预测方法。一种方法应基于专家知识规则,另一种方法应基于统计学。(Q)SAR模型采用的这些预测方法学应遵循经济合作与发展组织(OECD)制订的一般的验证原则。如果经两种互补的(Q)SAR方法(专家知识规则和统计学)预测均没有警示结构,则足以得出该杂质没有致突变性担忧的结论,不建议做进一步的检测(归为表1中的5类)。对计算机系统得到的任何阳性、阴性、相互矛盾或无法得出结论的预测结果,如有必要,申请人可根据专业知识进行综合评估,提供进一步支持性证据,合理论证并得出最终结论。对具有警示结构(表1中的3类)的杂质可采取充分的控制措施,或者对该杂质单独进行细菌致突变试验。如果杂质规范的细菌致突变试验(注释2)结果为阴性,则可以推翻任何基于结构的担忧,不建议进行进一步遗传毒性评估(注释1)。这些杂质视为非致突变杂质(表1中的5类)。如果细菌致突变试验为阳性,则需要进行进一步的危害评估和/或采取控制措施(表1中的2类)。例如,如果杂质水平不能控制在一个适当的可接受限度,则建议进行体内基因突变试验,以了解在体内环境下细菌致突变试验结果的相关性。其它体内遗传毒性试验的选择应根据杂质的反应机理和预期靶组织暴露(注释3)的知识进行科学地论证。体内试验的设计应参考现行ICH遗传毒性试验相关指导原则。符合要求的体内测试结果可支持特定杂质限度的设定。 与原料药或相关化合物具有相似的警示结构(例如,在相同位置和相同化学环境下具有相同警示结构)的杂质,如其(明确)细菌致突变试验为阴性,则可视为非致突变杂质(表1中的4类)。根据第6节所述的危害评估方法,每个杂质应按表1中的5个类别进行分类。本节介绍了推导1、2、3类杂质可接受摄入量的风险表征原则。基于TTC计算可接受摄入量时,单个致突变杂质每人每天摄入1.5 μg时其风险认为是可以忽略的(终生暴露情况下理论患癌风险小于十万分之一),这一值可以通用于大部分药物,作为可接受控制限度的默认值。TTC方法一般用于长期治疗用(>10年)药物中存在且无致癌性数据(2类和3类)的致突变杂质。7.2基于特定化合物的风险评估数据制订可接受摄入量7.2.1 具有阳性致癌性数据的致突变杂质(表1中的1类)如果有足够的致癌性数据,则应采用该特定化合物的风险评估数据来推导可接受摄入量,而非基于TTC的可接受摄入量。对于已知的致突变致癌物,其可接受摄入量可以根据致癌性强度计算,通常采用线性外推法计算。或者也可以采用其它已确认的风险评估方法。例如,可使用国际公认机构所采用的方法计算可接受摄入量,或直接使用监管机构已公布的测定数据(注释4)。对于与已知的某类致癌化合物在化学结构上相似的杂质,可以具体问题具体分析,对该特定化合物的可接受摄入量按照相似的致癌化合物的可接受摄入量进行计算,但前提是必须提供该杂质与已知化合物化学结构相似的理由以及支持性数据。(注释5)。人们逐渐认识到,存在某些作用机理,化合物剂量与效应之间的关系不完全是线性的,可能需要浓度达到一定阈值,这一现象在不以DNA为靶点的化合物和DNA反应活性化合物中都存在。这些物质发挥效应可能受到一些影响,例如,在与DNA接触前被降解失活,或产生的损伤可被有效地修复。对这些化合物的监管,在可获得相关数据的前提下,可通过未观察到作用水平(No Observed Effect Level, NOEL)和使用不确定性因子(参见ICHQ3C(R5),参考文献7)来计算允许日暴露量(permissible daily exposure, PDE)。化合物特定的经风险评估推算的可接受摄入量(第7.2节)可按后续章节(7.3.1和7.3.2)所述比例根据更短的使用时间进行调整,或应控制在不超过0.5%,二者取较低者。例如,如果终生暴露时某化合物可接受摄入量为15 μg/天,短于终生暴露时限度(表2)可以增加至100 μg(>1-10年治疗时长),200 μg(>1-12个月)或1200 μg(<1个月)。但是,对于最大日服用剂量已知的药物-例如最大日服用剂量100 mg,则<1个月时长的每日可接受摄入量应限制在0.5%(500 μg),而不是1200 μg。已知致癌物的标准风险评估方法假定了癌症风险与累积剂量呈正相关。因此,终生以低剂量持续给药与在较短时间内给予相同累积暴露量的药物在患癌风险上是等同的。
基于TTC的可接受摄入量1.5 μg/天被认为是安全的终生日暴露量。药品中致突变杂质的LTL暴露量可理解为可接受的累积终生摄入量(1.5 μg/天×25,550天=38.3 mg)在LTL期间均匀分配在总暴露天数中。即允许致突变杂质日摄入量高于终生暴露时的日摄入量,其风险水平与终生每日或非每日服药相当。表2是从上述概念推导而得的数据,说明了临床研发阶段和上市阶段LTL至终生暴露时的可接受摄入量。间歇给药时,每日可接受摄入量应根据给药总天数计算,而不是服药开始至停药的总时间跨度,给药天数需符合表2中相关的给药时长分类。例如,2年期间每周服用一次的药物(即给药104天),其可接受摄入量为每日20 μg。7.3.1临床研发阶段
上述LTL方法为有限的治疗时间段的临床试验,如1个月、1-12个月以及超过1年的临床研究直至完成Ⅲ期临床试验,推荐了致突变杂质的可接受摄入量(表2)。这些调整后的可接受摄入量在收益还未确定的早期临床开发中维持了百万分之一(10-6)的致癌风险水平,在后期研发阶段控制在十万分之一(10-5)的致癌风险水平(注释6)。对于给药周期不超过14天的I期临床试验,不必严格采用上述致突变杂质经调整后的可接受摄入量,可采用以下替代方法。该替代方法仅要求将1类和2类,以及被列入关注队列的杂质控制在第7节所述的可接受限度内(参见8节)。所有其它杂质按非致突变杂质控制,其中包括3类杂质,因I期临床持续时间有限,无需进行评估。对于已上市药品,绝大多数患者可按照表2中根据治疗时间确定可接受摄入量。所拟定的摄入量以及应用这些摄入量的各种情形均在注释7表4中进行了说明。在某些情况下,患者中一部分人群可能会延长治疗时间至超出该类药品预期使用时间的上限(例如,可接受摄入量为10 μg/天的药品治疗时间超出10年,可能达到15年)。与大部分治疗10年的患者计算所得的整体风险相比,可以忽略治疗时间延长所导致的风险增加(如上例,患癌风险增加至1.5/100000)。根据TTC得出的可接受摄入量适用于每个单杂。如果有两个2类或3类杂质,应单独制订各自限度。对于临床研发和已上市的药品,如果原料药质量标准中有3个或更多的2类或3类杂质,应按照表3所述制订总致突变杂质限度。只有订入原料药质量标准中的2类和3类杂质应计入总限度。已具有可接受摄入限度的特定化合物或特定类别化合物(1类),不应计入2类和3类杂质的总限度。另外,制剂中形成的降解产物应单独控制,不应计入总限度。•如果某杂质通过其它途径在人体中的暴露量更大,如食品或内源性代谢物(例如甲醛),则更高的可接受摄入量可能是合理的。•在严重疾病、预期寿命缩短、迟发的慢性疾病或治疗选择有限的特殊情况下,可根据具体情况制订合理的可接受摄入量。•致突变物中某些结构的化合物存在高致癌风险(“关注队列”),即黄曲霉毒素类物质、N-亚硝基化合物、以及烷基-氧化偶氮结构化合物。如果药物中存在这些杂质,则这些高致癌风险化合物的可接受摄入量可能会显著低于本指导原则中定义的可接受摄入量。尽管仍可以使用本指导原则的策略,但是,通常应针对各案情况开发研究方法,例如,使用结构紧密关联的化合物的致癌数据(如果有)来证明制剂研发阶段和上市产品中可接受摄入量的合理性。第7节所述的以上风险控制方法适用于所有的给药途径,通常不需要对可接受摄入量进行修正。对于特殊给药途径(如吸入给药),应根据具体情况进行逐案评估。由于采用的风险评估方法较为保守,上述方法适用于所有患者人群。控制策略是一套基于对当前产品和对工艺的理解而制订的有计划的控制方法,用以保证工艺性能和产品质量(ICH Q10,参考文献8)。控制策略包括但不限于以下内容:•物料属性控制(包括原料、起始物料、中间体、试剂、溶剂、内包材);
•设施和设备操作条件;
•生产工艺设计中隐含的控制;
•过程控制(包括过程检测和工艺参数);
•原料药和制剂的控制(如放行检测)。
如果一个杂质已经定性为表1中的1、2或3类杂质,为了保证该杂质在原料药和制剂中的水平低于可接受限度,构建一个专门的控制策略是至关重要的。构建适当的控制策略的基础是要全面理解原料药生产工艺相关的化学信息、制剂生产工艺以及原料药和制剂的整体稳定性。制剂中致突变杂质的控制策略与ICH Q9(参考文献9)中描述的风险管理过程应一致。基于对产品和工艺的理解以及风险管理原则,控制策略将工艺设计和控制与合适的分析测试相结合,可将控制点向上游移动并为尽量减少终产品测试提供可能性。
8.1工艺相关杂质的控制
原料药质量标准中包含杂质检查项,采用合适的分析方法将杂质控制在可接受限度以内。方法1的控制方式可以根据ICH Q6A(参考文献10)进行定期确认性检测。如果在至少6个连续的中试批次或3个连续的生产批次中,原料药中的致突变杂质水平均低于可接受限度的30%,则可证明定期确认性检测是合理的。如果不满足该条件,则建议作为原料药质量标准中的常规检测项。更多考虑事项请参见第8.3节。在原料、起始物或中间体的质量标准中包含杂质检查项,或作为过程控制项,采用合适的分析方法将杂质控制在可接受限度以内。在原料、起始物料或中间体的质量标准中对杂质进行检测,或进行过程控制,制订一个高于原料药中该杂质可接受限度的标准,使用合适的分析方法并结合对杂质去向和清除的认知,及相关的工艺控制,保证原料药中的杂质的水平低于可接受限度而无需在后续工艺中再行检测。对实验室规模试验(鼓励采用掺杂实验)的数据进行分析(必要时可以采用中试规模或商业规模批次数据加以佐证),如果原料药中杂质水平低于可接受限度的30%,则采用该方法是合适的。见案例1和2。也可以用其他方法来证明方法3的合理性。明确工艺参数及其对残留杂质水平(包括去向和清除知识)的影响,确信原料药中的杂质水平将会低于可接受限度,则建议无需对该杂质进行分析检测(即不需要将杂质订入任何质量标准中)。如已充分了解对致突变杂质水平有影响的合成工艺和工艺参数,最终原料药中这些杂质残留量高于可接受限度的风险很小,则可用针对合成工艺的控制策略代替分析检测。很多情况下只需根据科学原理对控制方法进行论述即可。可以使用科学风险评估要素来论证方法4的使用。风险评估可基于物理化学性质和影响杂质去向和清除的工艺参数,如化学反应性、溶解性、挥发性、电离度和任何设计用于去除杂质的物理过程。该风险评估的结果可表示为该工艺清除该杂质的预估清除因子(参考文献11)。方法4特别适用于那些自身不稳定的杂质(例如,与水迅速完全反应的二氯亚砜),或那些在合成路线早期引入并可被有效清除的杂质。有些情况下,如果已知杂质成因或合成后期引入的杂质,也可采用方法4;但此时需要提交针对该工艺的数据来论述采用该方法的合理性。与采用方法3时一样,采用方法4时,如仅根据科学原理来进行论述是不够充分的,需提交分析数据来支持控制方法。提交的资料可包括:在下游化学反应中导致杂质结构改变的相关信息(去向)、中试批次的分析数据,某些情况下可提供实验室规模下加样研究结果。在这些情况下,证明该杂质的去向/清除的论据的可靠性是至关重要的,它能够自始至终地保证最终原料药中杂质残留量超过可接受限度的可能性可以忽略。如果清除因子是根据研发数据得到的,须注意评估其规模依赖性或非依赖性。如果用于研发阶段的小规模模型被认为不能代表商业规模,则需要确认中试规模和/或初始商业批次中所用的控制是适当的。根据由实验室或中试规模数据计算所得的清除因子大小、杂质引入步骤和对下游工艺清除工艺的理解,决定是否需要中试/商业批次数据。如果使用方法3和4不能得到合理论证,则应在原料、起始物料或中间体的质量标准中对杂质进行检测或进行过程控制(方法2);或在原料药的质量标准中对杂质进行检测(方法1),将杂质控制在可接受限度内。对于在最终步骤中引入的杂质,除另有论述外,一般应采用方法1的控制方法。如果致突变杂质的水平低于可接受限度,则不必应用“合理可行的最低程度”(as low as reasonably practicable, ALARP)原则。同样地,也不必证明已摸索过可替代的合成路线。如果通过控制仍不能将致突变杂质的水平降低至可接受限度以内,而杂质是“合理可行的最低程度”水平,则可根据风险/收益分析来论证更高限度的合理性。上述这些方法中包括了建议将检测订入质量标准,但可能不必对每批产品均进行常规放行检测的情形。这种方法在ICH Q6A中被称为定期检测或间隔检测,也可以称为“定期确认性检测”。如果能证明杂质形成/引入之后的工艺能清除该杂质,则该方法也是合理的。要注意的是,是否允许使用定期确认性检测取决于是否使用受控状态下的工艺(即,生产出的产品质量能持续满足质量标准,并符合已建立的合适的设施、设备、工艺和操作控制方案)。如果检测结果显示,致突变杂质的水平不符合定期检测所建立的可接受标准,则药品生产商要立即实施全面检测(即对每个批次的特定属性进行检测)直至最终找出失败的原因、实施了纠正措施,并且书面证明该工艺已再次处于受控状态。正如ICH Q6A中所述,如果定期确认性检测失败,应通知监管机构评估先前放行未经检测的批次的风险/收益。对于已经定性为具有致突变性的潜在降解杂质,需了解其降解途径与原料药和制剂的生产工艺和/或其拟定的包装和储藏条件的相关性。建议采用一个设计良好的在拟定的包装中的加速稳定性试验(例如,40°C/75%相对湿度,6个月),采用适当的分析方法来确定潜在降解产物的相关性。也可以采用一个设计良好的动力学等效的时间更短、温度更高的稳定性试验,使用拟定的商业包装,在开始长期稳定性试验前确定降解途径的相关性。对于那些依据潜在降解途径的知识应该存在,但在产品中尚未观察到的潜在降解产物,这类研究对明确其相关性尤其适用。根据这些加速试验的结果,如预计降解产物将在拟定包装和储藏条件下形成,且接近可接受限度水平,则应采取措施控制降解产物的形成。这种情况下,除另有论述外,应在拟定储藏条件下(采用拟定的商业包装),监测用于确定有效期的长期稳定性批次原料药或制剂中的降解产物。该致突变降解产物的质量标准限度是否合理通常取决于这些稳定性研究的结果。如果预计制剂研发和包装设计的选择不能将致突变降解产物水平控制在可接受限度以下,而杂质是“合理可行的最低限度”水平,则可以根据风险/收益分析来论证更高限度的合理性。ICH Q10所述的质量体系要素和管理职责意在鼓励在生命周期各阶段使用基于科学和基于风险的方法以促进药品在整个生命周期中持续改进。产品和工艺知识应从研发阶段开始进行管理,贯穿产品的整个商业化生命周期,直至产品退市。对原料药和制剂的生产工艺的研发和改进一般会在其生命周期中持续进行。生产工艺性能,包括控制策略的有效性,应定期进行评估。从商业化生产中所获得的知识可用于进一步提高对工艺的理解和工艺性能,并对控制策略进行调整。拟对生产工艺的任何变更均应评估其对原料药和制剂质量产生的影响。该评估应当基于对生产工艺的理解,并应明确是否需要适当的检测来分析拟定变更的影响。另外,对分析方法的改进可能促进对杂质进行结构鉴定。在这种情况下,需要按本指导原则的要求对新结构的杂质致突变性进行评估。药品整个生命周期中,当工艺发生了计划内或计划外变更时,需重点重新评估是否需进行检测。这适用于对可接受限度没有常规监控的情况(方法3或方法4的控制方法),或采用定期检测而不是每批检测的情况。该项检测应在生产工艺中适当的中控点进行。在某些情况下,应用统计过程控制和工艺参数测量值的变化趋势有益于改善工艺持续适用性和工艺控制能力,从而对杂质控制更加充分。即便不对杂质进行常规监控(例如方法4),统计过程控制也可以基于对杂质形成或清除有影响的工艺参数进行。所有的变更应作为质量体系(ICH Q10)的一部分遵循内部变更管理流程。对已批准的申报资料中的内容进行变更应根据当地法规和指导原则的要求向监管机构进行报告。众所周知,对产品和工艺的认知在研发过程中是不断增长的,因此,在临床试验阶段用于支持控制策略的数据会比上市注册阶段少。鼓励根据工艺的化学基础,基于风险,优先分析最可能出现在原料药或制剂中的杂质。出现可能性很低的杂质早期临床阶段可不要求分析数据;但相同情况下,上市申请时宜提供分析数据以支持其控制策略。认可商业化处方是在临床研发后期才确定的,因此在早期阶段与制剂降解产物相关的研究会比较有限。•在整个临床研发期间,应逐渐累积致突变性的结构,持续收集分析数据。•对于14天或更短的I期临床试验,要提供努力降低致突变杂质的风险所采取的措施的描述,重点关注1类和2类杂质及第7节所列的关注队列中杂质。对于多于14天的I期临床试验和Ⅱa期临床试验,还应包括需要分析控制措施的3类杂质。•对于Ⅱb期和Ⅲ期临床试验,需提供一份经(Q)SAR评估的杂质清单,并描述实际存在的和潜在的所有1类、2类和3类杂质及其控制计划。应描述评估所用的计算机(Q)SAR系统。应报告实际杂质的细菌致突变试验的结果。•如第8.6节所述,对于存在可能性很低的潜在杂质,可以采用化学论证替代分析数据。•如根据本指导原则对实际和潜在的工艺相关杂质和降解产物实施了评估,则应提供致突变杂质分类及其理由:应包括所使用的计算机(Q)SAR评估体系的结果和描述,并合理提交支持性信息以得出4类和5类杂质的总体结论。如果对杂质进行了细菌致突变试验,应提交杂质细菌致突变试验的研究报告。•应提交拟定的质量标准和控制方法的合理性说明(例如,ICH Q11例5b,参考文献12)。例如,该信息可包括可接受摄入量,相关常规监测的位置和灵敏度。对于方法3和方法4的控制方法,需总结清除因子,明确相关控制要素(例如,工艺步骤、洗液中的溶解度等)。注1 ICH M7指导原则中的建议提供了一种目前最先进的方法来评估杂质诱发点突变的可能性,保证这样的杂质被控制在安全水平,从而在低于或高于ICH Q3A/B界定阈时无需进一步界定致突变可能性。该方法包括预先使用(Q)SAR工具来预测细菌致突变性。如果在长期给药时该杂质日摄入量超出1 mg,应按照ICH Q3A/Q3B的建议考虑进行潜在遗传毒性评估。如果该杂质日摄入量少于或等于1 mg,无论其它界定阈如何,都无需进行进一步的遗传毒性试验。注2为了评估杂质的潜在致突变性,可根据ICH S2(R1)和OECD471指导原则(参考文献13和14)制订全面充分的试验计划方案仅开展细菌致突变试验。试验宜符合GLP规范;但是,不完全符合GLP并不一定意味着所得数据不能用于支持临床试验和上市许可,不符合GLP的偏差应在研究报告中进行描述。例如,试验样品的制备和分析可能不符合GLP规范要求。在某些情况下,检测用细菌菌株可能会被限制在那些经证明对已鉴别的对警示结构敏感的菌株之中。对于不易分离或合成的杂质,或化合物数量有限的杂质,可能无法达到目前试验指导原则所推荐的符合ICH要求的细菌致突变试验的最高试验浓度。这种情况下,细菌致突变试验可以采用小型化的微量的(miniaturized assay format)测试方法,并证实该方法与符合ICH的测试高度一致,以确保在较高的浓度下进行测试也能符合要求。注3研究体外致突变物(细菌致突变为阳性)的体内相关性的试验 | |
| •任意细菌突变性结果为阳性时;需论证选择试验组织/器官的理由时 |
| •检测直接诱变剂对于直接作用的致突变物(细菌突变试验在非S9代谢活化条件下结果为阳性时)* |
| •检测直接诱变剂(细菌突变试验在非S9代谢活化条件下结果为阳性时)和已知染色体断裂剂 |
| •尤其是细菌突变试验仅在S9代谢活化条件下结果为阳性时 |
| •应提供理由(可形成碱基不稳定位点或单链断裂这些可导致突变形成的DNA前期损伤的化学结构特异性作用模式) |
| |
*对于间接作用的致突变物(需要代谢活化),要证明有足够的代谢物暴露量。可以根据啮齿类动物致癌效价数据,例如TD50值(导致50%肿瘤发生率的给药剂量相当于患癌风险可能性水平为1:2),来计算特定化合物的可接受摄入量。通过简单地将TD50值除以50000来线性外推至十万分之一的发生率(即可接受的终生风险水平)。该方法类似于TTC使用的推导方法。根据致癌性数据库(CPDB数据库官方名称),环氧乙烷的TD50为21.3 mg/kg体重/天(大鼠)和63.7 mg/kg体重/天(小鼠)。在计算可接受摄入量时,采用了剂量较低的大鼠值(即更保守)。为推导十万分之一致癌率的剂量,将该值除以50000:21.3 mg/kg÷50,000=0.42 µg/kg.0.42 µg/kg/日×50 kg体重=21.3 µg/人/天。因此,终生每日服用21.3 μg环氧乙烷对应十万分之一的理论致癌风险,也是环氧乙烷在原料药中作为杂质存在时的可接受摄入值。使用啮齿类动物致癌性研究中最保守的TD50值并不不考虑其与人类相关性的,作为该方法的替代方案,可以对已有致癌性数据进行深度毒理学专家评估,以便首先确定与人类风险评估相关性最高的发现(例如,物种,器官),作为推导线性外推参考点的依据。同样的,为了更好地直接考虑剂量-反应曲线的形态,可以使用基准剂量代替TD50值作为致癌效价的量化指标,例如基准剂量置信区间下限10%(BMDL10,有95%的概率确信预估的最低剂量不会导致啮齿类动物的致癌率超过10%)。通过简单地将BMDL10除以10000来线性外推至十万分之一的发生率(即终生风险水平),即得。特定化合物的可接受摄入量也可以使用国际公认机构公布的推荐值,如世界卫生组织(WHO,化学品安全国际规划署[IPCS]癌症风险评估程序),以及其它合理使用的十万分之一终生风险水平的值来推导。一般来说,应用的监管限度应以最新的科学支持性数据和/或方法为基础。注5 对于化学结构与已知致癌物类似的致突变杂质(没有致癌性数据),可以采用化合物特异性的方法来计算致突变杂质的可接受摄入量。例如,单官能团烷基氯化物为药物合成中常见物质,现已明确其致癌强度相关因素(参考文献15),可用于制定所有单官能团烷基氯化物的安全可接受摄入量。与多官能烷基氯化物相比,单官能团烷基氯化物的致癌性较低,TD50值介于36至1810 mg/kg/天之间(n=15;具有两个明显不同官能团的表氯醇除外)。TD50值36 mg/kg/天则可以作为一个非常保守的特异分类的效价参考点,来计算单官能团烷基氯化物的可接受摄入量。该效价水平至少比与默认的终生TTC(1.5 μg/天)对应的TD50(1.25 mg/kg/天)低10倍,因此证明了单官能团烷基氯化物的终生和短于终生的每日摄入量是默认值的10倍。注6在建立临床研发阶段性TTC限度时,优先建立药品中致突变杂质短于终生的可接受摄入量(参考文献16)。短于终生的可接受摄入量(AI)根据Haber法则来进行计算,该法则是毒理学的基本概念,认为浓度(C)×时长(T)=常数(k)。因此,致癌性作用同时基于剂量和暴露时长。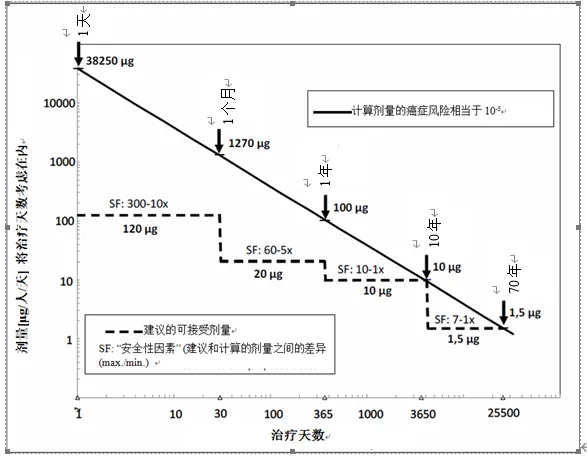 图1:图示是致突变杂质的日剂量计算值(对应理论上十万分之一的患癌风险)与治疗时长的函数关系,与第7.3节拟定的可接受剂量的比较。图1中的实线代表致突变杂质每日摄入量(对应十万分之一患癌风险)与治疗天数的线性关系。根据本指导原则中终生治疗所用的TTC水平(即1.5 μg/人/天)进行计算,公式如下:短于终生的AI=1.5 μg×(365天×70年寿命=25550)治疗总天数治疗时长为70年时计算的每日摄入水平为1.5 μg,10年为10 μg,1年为100 μg,1个月为1270 μg,单次给药约为38.3 mg,所有这些结果均来自于相同的累积摄入量,因此理论上具有相同的患癌风险(十万分之一)。台阶式虚线代表的是实际每日摄入水平,它是依据本指导原则第7节为临床研发和已上市药品的建议调整为短于终生暴露的可接受摄入量。这些拟定的摄入水平一般显著低于计算值,因而安全因子随着治疗时长的变短而增加。如果治疗时长不超过6个月,所拟定的每日可接受摄入量也符合百万分之一的患癌风险水平,因此适用于获益尚未明确的志愿者/患者的早期临床试验。在此情况下,上图所示的安全因子要降低十倍。注7表4:临床使用情形举例:在不同治疗时长下应用可接受摄入量
图1:图示是致突变杂质的日剂量计算值(对应理论上十万分之一的患癌风险)与治疗时长的函数关系,与第7.3节拟定的可接受剂量的比较。图1中的实线代表致突变杂质每日摄入量(对应十万分之一患癌风险)与治疗天数的线性关系。根据本指导原则中终生治疗所用的TTC水平(即1.5 μg/人/天)进行计算,公式如下:短于终生的AI=1.5 μg×(365天×70年寿命=25550)治疗总天数治疗时长为70年时计算的每日摄入水平为1.5 μg,10年为10 μg,1年为100 μg,1个月为1270 μg,单次给药约为38.3 mg,所有这些结果均来自于相同的累积摄入量,因此理论上具有相同的患癌风险(十万分之一)。台阶式虚线代表的是实际每日摄入水平,它是依据本指导原则第7节为临床研发和已上市药品的建议调整为短于终生暴露的可接受摄入量。这些拟定的摄入水平一般显著低于计算值,因而安全因子随着治疗时长的变短而增加。如果治疗时长不超过6个月,所拟定的每日可接受摄入量也符合百万分之一的患癌风险水平,因此适用于获益尚未明确的志愿者/患者的早期临床试验。在此情况下,上图所示的安全因子要降低十倍。注7表4:临床使用情形举例:在不同治疗时长下应用可接受摄入量 | |
| 疗程≤1个月:例如,用于急救的药品(解毒、麻醉、急性缺血性脑卒中),日光性角化病、除虱 | |
| 疗程在1-12个月之间:例如,最长可达12个月的抗感染治疗(丙型肝炎病毒)、肠外营养、预防性的流行性感冒药物(约5个月)、消化性溃疡、人类辅助生殖技术(ART)、早产、先兆子痫、术前(子宫切除术)治疗、骨折愈合(短期使用但半衰期长) | |
| 疗程在1-10年之间:例如,疾病预期生存期较短的阶段(严重阿尔茨海默病)、使用非遗传毒性抗癌药治疗的具有较长生存期的患者人群(乳腺癌、慢性髓性白血病),特别标明使用期应短于10年的药品,间歇性给药治疗急性复发症状2(慢性疱疹、痛风发作、物质依赖如戒烟)、黄斑变性 | |
| 疗程>10年:例如,很可能会跨年龄段终生使用的慢性适应症(高血压、血脂异常、哮喘、阿尔茨海默症(除严重阿尔茨海默病外))、激素治疗(例如,生长激素、甲状腺素、甲状旁腺素)、脂肪代谢障碍、精神分裂症、抑郁症、银屑病、特应性皮炎、慢性阻塞性肺病(COPD)、囊肿性纤维化、季节性和常年性过敏性鼻炎、人类免疫缺陷病毒(HIV)3 | |
1表格显示的是一般案例;每个案例应逐案审查。例如,在患者预期生命有限时(如严重的阿尔海默茨病),即使用药时长可能超过10年,10 µg/天也可能被接受。2间隔用药>10年,但基于累积剂量在1-10年范围内。由于临床治疗技术的进步,M7(R2)中将HIV患者的生存期从1-10年修改为>10年。见Q&A。可接受摄入量(Acceptable intake):在本指导原则中,可接受摄入量是指一个特定的(杂质)摄入量水平,当不超过这一水平时,由于杂质摄入所导致的致癌性风险可以忽略不计;或者是通过适当的利弊权衡之后对严重/危及生命的适应症确定的摄入水平。从可接受摄入量和药物每日剂量推导而来的原料药或制剂中杂质的最大可接受浓度。可接受标准(Acceptance criterion):针对特定分析方法的检测结果设定的可以量化可接受限度、范围或其他要求。控制策略是基于对当前产品和对工艺的理解而制订的一套用以保证工艺性能和产品质量的有计划的控制方法。控制方法可包括与原料药、制剂物料和各组分相关的参数和属性、设施/设备的操作条件、过程控制、终产品质量标准、监测和控制的相关方法和频率。累积摄入量(Cumulative intake):降解产物(Degradation Product):药物分子受时间和/或受光、温度、pH、水或与辅料的作用和/或直接包装/密闭系统的影响发生化学变化而产生的物质。通过与DNA发生化学反应直接诱导DNA损伤的潜在能力。在本指导原则中,专家知识可定义为综述已存在的数据并使用任何其他相关信息来评估计算机模型预测致突变性的精确度。一个广泛的术语,指的是遗传物质中的任何有害变化,而不考虑诱发该变化的机制。致突变杂质(Mutagenic impurity):已在合适的致突变试验模型(如细菌致突变试验)中确证具有致突变性的杂质。定期确认性检测(Periodic verification testing):(Q)SAR和SAR((Q)SAR and SAR):在本指导原则中,是指使用(定量)构-效关系的实验数据说明化合物分子(亚)结构与致突变活性之间的关系。清除反映了一个工艺降低杂质水平的能力。清除因子的定义是指工艺中上游点的杂质水平除以工艺中下游点的杂质水平。清除因子可进行测定或预测。在本指导原则中,与致突变性相关的化学基团或分子(亚)结构。
