试析中药新药药效与非临床毒性研究的相关性
药审要点 | 试析中药新药药效与非临床毒性研究的相关性
文章来源:中国中药杂志 2017 年第42卷第20期:4045-4048
试析中药新药药效与非临床毒性研究的相关性
游云1 ,李建荣1 ,黄芳华2 ,韩玲2*
(1. 中国中医科学院 中药研究所2. 国家食品药品监督管理总局 药品审评中心)
摘要:该文根据中医药的临床证候与西医疾病的相互关系,对部分中药新药药效与非临床毒性研究的相关性进行了分类。如果中药药效靶点与现代医学一致,或者是以毒为能的中药制剂,中药复方的毒性表现往往可见到药效的放大与延伸; 中药药效靶点与现代医学有交叉但又不完全一致,或者二者之间无交叉的情况下,中药复方的毒性往往不能从药理作用预测。随着中药活性部位提取分离技术的提高,中药新辅料的应用,某些中药复方制剂毒性可能来自于与药效无关的反应。分析结果提示研究人员应关注中药毒理学试验方案的设计及研究过程的质控等问题,综合多学科分析评价中药的药效及毒性特点。
关键词: 中药; 药效; 毒性; 相关性
中医药从神农尝百草开始,在几千年的发展中积累了大量临床经验,并对自然资源的药用价值进行了独特的归纳整理。随着现代制药研发技术的成熟与进步,中药新药研发也获得了巨大进展。在新药研发过程中,药物效应与药物毒性息息相关,特别是有些药物在其毒性研究中发现的副作用,可以作为药物发现的新靶点; 而某些药物的药理效应,在重复给药毒性试验中可能因剂量增大或服用周期延长而出现药理效应放大成为毒性反应。一般来讲,化学药毒性与药理作用的相关性大致包括: 毒性是药理作用的延伸或扩大;毒性是由与药效无关的药理作用所引起,如抗生素引起的血液、肝、肾毒性; 毒性无法通过已有的药理作用进行预测,如免疫毒性等。
中药复方( 单方) 有长期传统的临床应用经验,积累了人用的有效性和安全性信息; 现代研究表明中药复方制剂药理效应缓和,起效较慢,量效关系形式多变; 作用机制表现为多途径、多靶点、多系统。由于中药作用特点的多样性,中药起效成分 / 组分的不确定性,中药复方药效与毒性的关系较上述情况更为复杂。本文通过调研部分中药药效及毒性试验的数据,对中药新药临床前药效与毒性的相关性进行了初步的归纳整理( 图 1) 。
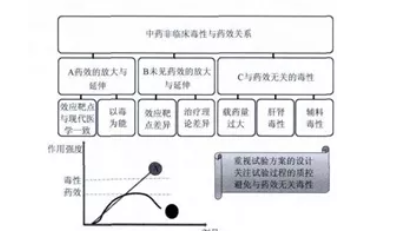
图 1 中药非临床毒性与药效关系示意图
1 中药制剂重复给药毒性表现为药效的放大与延伸
1.1 中药制剂的药理作用靶点与现代医学一致
如果在现有的药理学研究体系,中药的药效作用机制相对清晰,药物作用靶点与现代医学基本一致,那么在重复给药毒性试验中可以清楚地观察到药效的放大与延伸的毒性反应。譬如延胡索在唐代《本草拾遗》中即记载其具有止痛效应,罗通定是从延胡索中提取出来的主要成分延胡索乙素( 左旋四氢巴马汀) ,是多巴胺受体拮抗剂,具有弱的镇痛作用和强镇静作用; 其重复给药试验显示剂量过大可致嗜睡与椎体外系症状的中枢抑制作用[1]。
某些降脂类中药复方或者提取物,在重复给药毒性试验中也可以观察到对正常动物血清胆固醇 ( TC) 、甘油三酯(TG) 、低密度脂蛋白( LDL) 和高密度脂蛋白( HDL) 含量的影响。某些活血化瘀类中药,可以在重复给药毒性试验中观察到对凝血酶原时间( PT) 以及部分凝血酶原时间( APTT) 的延长效应。
1.2 “以毒为能”的中药制剂
中药的毒性往往与“中药偏性”、“以偏纠偏”的传统理论密切相关,一些有毒中药可以解决临床上的难治性疾病,如用于治疗肿瘤、自身免疫性疾病等,其药效作用理论与基础就是“以毒攻毒”。特别在一些清热解毒类的中药品种的重复给药毒性试验中也可观察到相应的药理学效应的放大,例如复方黄黛片,临床主要用于急性早幼粒细胞白血病,或伍用化疗药物治疗其他类型的白血病及真性红细胞增多症,其重复给药毒性试验研究显示出该品种降低犬血红蛋白含量的作用。临床上常用于治疗类风湿性关节炎的雷公藤系列药物,属于中药清热通痹类药物,药理作用主要表现为免疫抑制,而其重复给药毒性试验可见对骨髓系统的抑制作用,引起白细胞、红细胞、血小板数量的下降; 临床应用需要控制给药剂量及服用疗程。附子具有回阳救逆,散寒止痛功效; 现代药理研究附子具有强心作用,毒性试验结果显示,随着药物在动物体内的蓄积,附子显示出明显的心脏毒性,直至动物死亡[2]。
2 中药制剂重复给药试验未见药效的放大与延伸
传统中医临床多以症候为疗效指标,与现代医学对疾病病理生理规律的认识难以直接对应或衔接; 中药多成分、多靶点的复杂的作用机制,使得中药量效关系很不规则,量效曲线可能出现倒 U 型特征[3-5]。
中药对疾病模型动物及健康在这种情况下, 实验动物的毒性反应可能存在明显差异[6]。中药制剂在重复给药毒性试验未见明显毒性反应,未观察到药效的放大与延伸。
2.1 中西医对疾病的治则或治疗靶点有交叉但不完全一致
来源于临床经验的,用于治疗缓慢型心律失常的某中药复方,在药效学试验中观察到对真家兔窦房结损伤模型的影响,但是在重复给药毒性试验结果未显示对正常大鼠心电图的影响,采用遥测技术也未观察到对清醒比格犬心电图和血清电解质的明显影响。分析其处方组成,处方既含有人参、附子 2 味强心复脉的中药,又含有多味的益气活血中药如黄芪、当归、山药等,用于治疗症见胸闷憋气,心悸气短……倦怠乏力,面色晄白,脉来迟缓,脉结代,舌淡暗的患者,虽然该品种所辨治的部分症状与缓慢性心律失常病态窦房结综合征的部分症状有重叠,但是二者又不完全一致; 正是由于中医、西医对于疾病的分类差异,对患者以及症状的分层方法不同,导致了 2 种医学对疾病治疗理论的差异。现代医学往往通过对心脏电生理特征的认识,采用包括钠通道阻滞剂、β肾上腺素受体阻滞剂、钙通道阻滞剂等药物直接作用于心脏离子通道或受体而治疗各种类型的心律失常[7]。不论中医还是西医,均是采用对疾病的分层诊治,从而各自获得较优的诊疗效果。
2.2 中西医对疾病的治则或治疗靶点无交叉
中药是在我国传统医药理论指导下使用的药用物质及其制剂。目前中药新药的组方及所申请的适应症既有来自于临床经验的总结,也有来自于循证医学证据的提示,尚不能完全被当前的药理学研究体系所涵盖。譬如治疗失眠的中药复方或者单方,按照中医理论可分为: 养血宁心、补益心脾、补益心肾、补脾益肾、疏肝解郁和重镇安神等六大类,这些复方涉及到中医阴阳和脏腑辨证理论,与现代药理学的镇静催眠机制截然不同,因而在重复给药毒性试验中,往往观察不到对于中枢神经系统的抑制效应以及放大的药物镇静催眠效应。譬如由单味药茯苓组成的健脾安神胶囊,就是根据“胃不合则卧不安”的中医基础理论,通过健脾渗湿,发挥宁心安神的作用,治疗失眠、健忘、心悸等; 其重复给药毒性试验也观察不到放大的药物镇静催眠作用。
在临床实践中发现,中药对某些多因素疾病,特别是自身免疫性疾病、皮肤科疾病具有疗效优势,其在短期可缓解临床自觉症状,长期服用后可延缓疾病发展进程。其临床前药效学研究可通过疾病模型动物的组织病理学改变进行评价; 但正常动物的重复给药长期毒性试验却难以显示出药理效应的放大。
3 中药制剂毒性可能来自于与药效无关的反应
3.1 载药量过大引起的消化道毒性反应
由于中药复方药效缓和,毒性反应较弱[8-9],在某些中药复方的重复给药毒性试验中,研究者为了观察到中药复方在实验动物体内的毒性反应,往往采用增加给药体积的方法,甚至以实验动物最大允许给药体积长期给药,以增加载药量。然而,长时间、大剂量、高浓度药液给动物服用,超出了实验动物的适应范围,导致动物出现明显的胃肠道毒性,譬如摄食量下降,进而致体质量下降,大小便异常,肝重代偿性升高、肝脏系数升高,总蛋白含量升高等体征; 这些变化符合长期给药后出现的肝药酶活性适应性升高的表现。对于这种可能的非药效相关的毒性,可以通过增加每日给药次数,降低单次给药容积等方式加以避免。当然,如果实验动物的胃肠道反应具有剂量依赖性,并伴随病理学改变,则不能排除这种胃肠道毒性反应与药物相关。
3.2 辅料引起的毒性
近年来随着新技术新材料的发展,新的药用辅料也逐渐增多。但是如果药用辅料选择不当,可能会降低中药新药的安全系数; 如果中途更换辅料,则需重新开展毒理学等方面的研究。譬如某中药注射剂采用羟丙基倍他环糊精作为辅料,在大鼠 90 d 和犬 180 d 的重复给药毒性试验中,并未设置辅料对照组,各给药组动物表现出明显的肾脏毒性和肺脏毒性,包括肺组织的泡沫细胞团、肾小管上皮空泡样变性等病理学改变,以及某些肝、肾生化指标不可逆的增高; 由于无法排除辅料的毒性,毒理学试验结果未能确定安全范围。即使该品种与已上市的注射剂相比,使用的羟丙基倍他环糊精量较低,但是由于临床适应症不同,用药疗程不同,现有的人用经验安全数据也已无法支持该制剂进入临床试验。
同样的,另外一个中药品种的重复给药毒性试验结果显示,辅料对照组和各给药剂量组均出现了明显的脏器病理变化及肝肾生化指标的升高,由于在试验过程中未设置正常对照组和原料药组,导致无法判断试验数据与药物的相关性,因而未能得到安全剂量范围,现有的毒性试验结果也无法支持其进入临床试验。
3.3 长期反复用药后导致的肝肾等脏器毒性
某些中药复方( 包括单味药) ,在临床前重复给药毒性研究中也会观察与药效无关的肝肾毒性。肝肾对外源药物所作出的反应取决于暴露的强度和受损细胞的种类,当损伤超过其代偿功能时,将导致一系列的代谢障碍,表现出与药效无关毒性反应症状和体征。
例如某复方品种在大鼠 6 个月经口重复给药毒性试验的结果显示,给药期间各给药组动物体质量增长缓慢; 中、高剂量组肝脏系数、肾脏系数均升高。血液生化改变具有剂量相关性,3 个剂量组总胆红素( TBIL) 升高; 中、高剂量组谷丙转氨酶( ALT) 和碱性磷酸酶( ALP) 及尿素氮( BUN) 升高; 各指标的变化呈现明显量毒关系; 同时该复方品种的临床剂量和出现毒性反应的剂量接近,提示其安全范围较小; 上述试验结果无法支持该复方进行临床试验的安全性。某些单味药或者复方在对有效成分或部位富集之后,重复给药毒性试验结果也会表现出与药效不相关的肝肾及血液系统毒性反应。
4 关注中药毒理学试验方案的设计及研究过程的质控问题
2007 年国家食品药品监督管理局通知要求,“中药、天然药物注射剂、有效成分和有效部位新药非临床安全性试验必须在 GLP 认证通过的实验室进行”。截至目前,对于中药复方制剂的非临床安全性试验仍未强制要求在 GLP 实验室进行[10]。在审评资料中发现,有些中药复方品种在重复给 药毒性试验过程未遵从 GLP 要求,未进行严格的质控,实验动物在长期饲养过程会出现肺部感染、血液学异常、脏器功能异常等结果,信噪比降低,难以客观分析药物的非临床安全性。
随着我国实验研究条件的改善以及研究理念的转变,一些中药复方品种的非临床安全评价研究已经在 GLP 试验室开展,并开始关注并设计了与药效相关的毒性观察指标。譬如某种用于治疗妇女月经紊乱( 卵巢功能异常) 的可能对机体激素水平产生影响的中药复方制剂,在重复给药毒性试验中对动物血清性激素水平以及生殖器官( 子宫、卵巢) 进行了重点观察,试验结果对于分析大鼠的一些自发病变,排除与药物相关的毒性具有重要的参考意义。再比如某品种的适应症为复发性口腔溃疡,通过口腔黏膜给药,其药效学试验和重复给药毒性试验均进行了给药部位的组织病理检查,并与局部刺激性试验相互印证,为开展临床试验提供更为全面的数据支持。
此外,根据国家食品药品监督管理总局 2014 年发布的《药物重复给药毒性研究技术指导原则》,建议重复给药毒性试验分阶段进行,一方面可以支持不同期限的临床试验; 另一方面多种设计的重复给药毒性试验可以为注册评价提供更多的参考和支持[11]。根据受试物的属性、适应证以及所处研发阶段,在不同种属实验动物分别开展为期 1 周、2周……至 52 周等不同期限的重复给药毒性试验,在降低研发风险,确定受试物安全剂量范围,临床联合用药及不良反应监测[12]等方面可以提供更多临床前试验数据支持。对于上文所述因辅料引起的毒性,如果能通过分阶段的毒理学试验早期发现,通过及时更换辅料或者设置相应的对照组,从而降低研发失败的风险及成本。
综上,在中药新药研发过程中,重复给药毒性试验是非临床安全性评价的主要内容,应该密切结合药效学试验结果,以及药物拟申请的临床适应症,有针对性地设计重复给药毒性试验方案,对实验全程进行质量管理,有利于对中药药效作用特点以及安全特征进行全面分析。
5 结语与展望
通过结合药效学对中药新药重复给药毒性试验的分析和总结,笔者认为中药药理与毒性反应的相互关系更为复杂多样,一方面应通过科学规范的药理毒理研究全面、客观的认识中药的作用特点及其毒性反应; 另一方面需要科研人员对中药复方的量效关系、中医辨证的分类及聚类进行系统、深入的创新研究,融汇中西医学理论研究的学术成果,运用多学科的技术手段进行探索与研究,对中药的药效及毒性特点进行综合分析和评价。
参考文献
[1 ]Wang J B,Mantsch J R. l-tetrahydropalamatine: a potential newmedication for the treatment of cocaine addiction[J].Future MedChem,2012,4( 2) : 177.
[2 ]张硕峰,吴金英,贾占红,等. 附子中乌头碱对大鼠心功能效-毒剂量关系测定[J]. 中国实验方剂学杂志,2012,18 ( 19 ) :222.
[3 ]寇俊萍,朱丹妮,余伯阳,等. 中药复方系统研究中药理研究的思路与实践[J]. 中药新药与临床药理,2008( 1) : 73.
[4 ]程佳祎,史清文,王燕婷,等. 中药药理作用特点分析和制约中药发展因素初探[J]. 世界科学技术—中医药现代化,2012,14( 4) : 1926.
[5 ] 徐风,杨东辉,尚明英,等. 中药药效物质的“显效形式”、“叠加作用”和“毒性分散效应”由中药体内代谢研究引发的思考[J]. 世界科学技术—中医药现代化,2014,16( 4) : 688.
[6 ]王艳辉,赵海平,王伽伯,等. 基于“有故无殒”思想的熟大黄对肝脏量-毒 / 效关系研究[J]. 中国中药杂志,2014,39( 15) :2918.
[7 ]钱慕仪 . 抗心律失常药研究新进展[J]. 当代医学,2010( 4) :22.
[8 ]张晓东,李连达 . 浅议中药和化学药非临床安全性评价之异同[J]. 中药药理与临床,2010( 1) : 76.
[9 ]韩玲,杜晓曦 . 《药品注册管理办法》中中药复方制剂浅议[J]. 中国中药杂志,2004,29( 9) : 925.
[10]张晓东,韩玲,朱飞鹏 . 对当前中药复方制剂非临床安全性评价的若干思考[J]. 中国新药杂志,2009( 14) : 1294.
[11]笪红远,韩玲,王庆利 . 对《药物重复给药毒性研究技术指导原则》的解读[J].中国临床药理学杂志,2014,30( 8) : 744.[12] FDA. Pharmacology review[EB/OL].(2014-08-27)[2017-07-25].https://www.accessdata.fda.gov/
drugsatfda_docs /nda /2015 /125522orig1s000pharmr. pdf.