临床常用降压药的致癌性评价
药审要点 | 临床常用降压药的致癌性评价
文章来源:中国临床药理学杂志第35卷第10期2019年5月:1080-1084
临床常用降压药的致癌性评价
宁娜,王庆利,光红梅
国家药品监督管理局药品审评中心
[摘要]本文按作用机制分类,对降压药的非临床致癌性试验和临床肿瘤相关性研究进行了综述。临床回顾性分析受限于受试者入选排除标准、样本量或分析方法等试验设计因素,可能得出矛盾的结论。非临床致癌性试验仍然是衡量新药肿瘤风险的金指标。临床应用时应在现有研究的基础上,充分考虑风险获益比,进行科学用药。
[关键词]降压药; 致癌性试验; 回顾性分析; 科学用药
高血压是一种以体循环动脉收缩期和( 或) 舒张期血压持续升高为主要特点的全身性疾病,主要病理改变是动脉病变和左心室肥厚,可累及心、脑、肾等重要脏器。近50 年来,我国高血压患病率呈现逐年上升的趋势。使用降压药维持平稳的目标血压水平,可降低心血管事件的风险,对器官发挥保护作用,使患者受益。
降压药可能需要长期应用。药物在体内的长期暴露是否会引起DNA 损伤,甚至诱发突变、导致肿瘤发生是临床应用的重点关注问题。人用药品注册技术要求国际协调会议( ICH) 的技术指导原则S1A 中指出,预期临床连续或间歇使用至少6 个月的药物,都应在上市前进行致癌性实验。本文根据降压药的不同类型,针对其上市前非临床致癌性评价与临床使用的调查结果进行了综合分析。
1 降压药的基本分类
高血压的发病机制包括交感神经活动亢进、肾素- 血管紧张素-醛固酮系统激活、内皮细胞功能受损等。针对不同病理机制,可将降压药基本分为利尿剂、β 受体拮抗剂、钙通道阻滞剂( CCB) 、血管紧张素转换酶抑制剂( ACEI) 和血管紧张素Ⅱ受体拮抗剂( ARB) 。
2 非临床致癌性实验案例
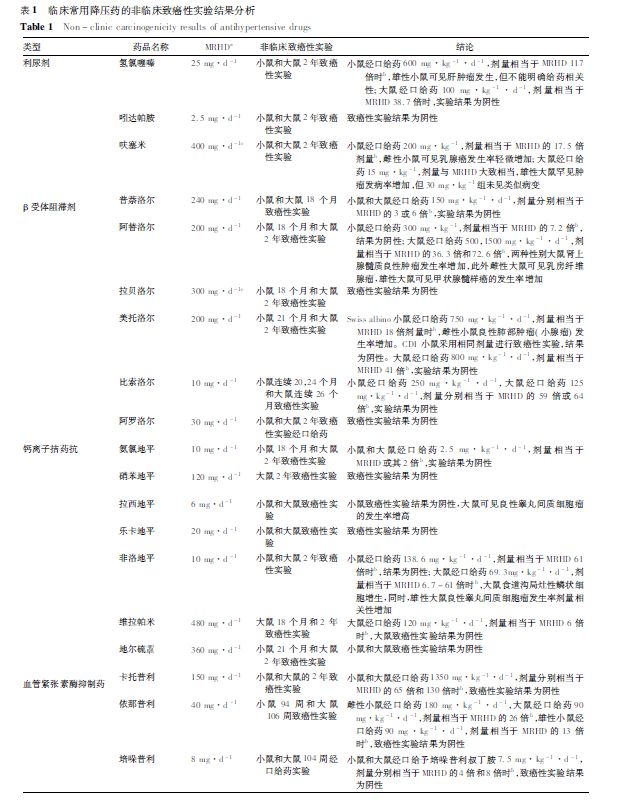
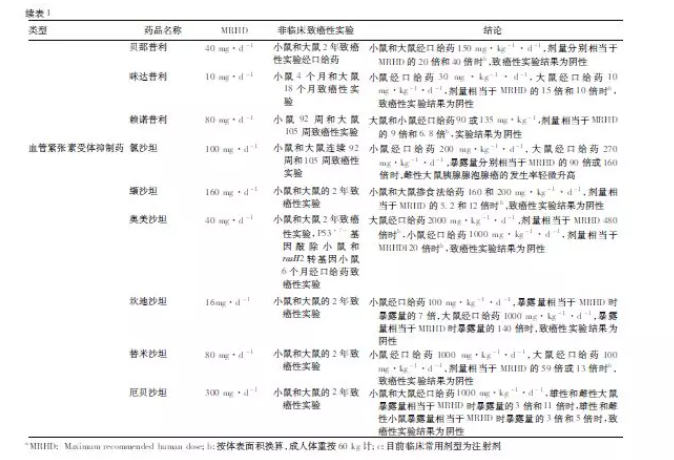
根据ICH S1B,非临床致癌性实验可由2 种啮齿类动物长期给药实验,或1 种啮齿类动物长期给药试验和转基因啮齿类动物中短期给药实验组成。现按降压药的基本分类,将药物在国内申请上市时,提交的非临床安全性评价资料或批准的说明书中致癌性实验结果进行归纳,见表1。
2. 1 利尿剂
利尿剂通过促进水、钠的排出,降低血容量,达到降压目的。常用的利尿剂可分为噻嗪类利尿剂、噻嗪样利尿剂以及髓袢利尿剂。噻嗪类利尿剂氢氯噻嗪的小鼠2 年致癌性实验可见肝肿瘤发生率增加,而噻嗪样利尿剂吲达帕胺的致癌性实验结果为阴性。髓袢利尿剂呋塞米的小鼠2 年致癌性实验中,雌性小鼠乳腺癌发生率增加,雄性大鼠罕见肿瘤发病率增加。
2. 2 β肾上腺素受体阻滞剂
β 肾上腺素受体阻滞剂可抑制血管平滑肌的交感神经活动,减少醛固酮的分泌,使血管张力下降,血压降低。目前常用的β 肾上腺素受体阻滞药包括普萘洛尔、阿替洛尔等。阿替洛尔是选择性β1肾上腺素受体抑制药,完成了多项非临床致癌性实验,但结果略有不同。阿替洛尔的小鼠18 个月致癌性实验和大鼠18 或24 个月致癌性实验结果均为阴性,但另一项大鼠2 年致癌性实验可见肾上腺髓质良性肿瘤发生率增加,此外雌性大鼠可见乳房纤维腺瘤,雄性大鼠可见甲状腺髓样癌的发生率增加。
2. 3 CCB
CCB 按结构可分为二氢吡啶类及非二氢吡啶类。二氢吡啶类可抑制钙离子进入血管平滑肌,起到扩张血管、降低外周血管阻力的作用; 而非二氢吡啶类除了对血管平滑肌钙通道的作用外,还对窦房结和房室结的钙通道产生作用,引起心率减慢,交感神经活性下降。
二氢吡啶类CCB 中,氨氯地平、硝苯地平等致癌性实验结果均为阴性,而拉西地平和非洛地平则均出现了大鼠良性睾丸间质细胞瘤增加。非二氢吡啶类CCB 中,维拉帕米和地尔硫的非临床评价均未见致癌性相关风险。
2. 4 ACEI
肾素-血管紧张素- 醛固酮系统( RAS) 是降血压药物的重要作用靶点。肾球旁细胞分泌的肾素可将血清中的血管紧张素原转化为无生理活性的血管紧张素Ⅰ,血管紧张素Ⅰ在血管紧张素转换酶作用下生成血管紧张素Ⅱ,收缩血管平滑肌,产生直接的升压效应,同时通过刺激醛固酮分泌,促进水、钠的重吸收等多种机制升高血压。ACEI 可抑制RAS 中血管紧张素转换酶的活性,减少血管紧张素Ⅱ的生成。可查询到的ACEI 非临床致癌性试验结果均为阴性。
2. 5 ARB
ARB 同样作用于RAS,可选择性拮抗血管紧张素Ⅱ与其1 型受体( AT1R) 的结合,抑制受体活化后的下游效应。氯沙坦是首个获批用于高血压的ARB,非临床致癌性实验可见雌性大鼠胰腺腺泡腺癌的发生率轻微升高。国内上市的其他ARB 非临床阶段分别完成了小鼠和大鼠2 年致癌性实验,或转基因小鼠6个月致癌性实验,结果均为阴性。
3 临床分析
3. 1 利尿剂
研究发现[1],噻嗪类利尿剂有光敏感结构,可导致DNA 氧化损伤及环丁烷嘧啶二聚体( CPDs) 的形成,诱发皮肤光敏感部位的肿瘤。FRIEDMAN 等[1]通过临床试验发现,氢氯噻嗪用药时间超过5 年的人群罹患唇癌的风险是对照组的4 倍。目前,国际肿瘤研究机构( IARC) 已将氢氯噻嗪分级为“可能对人体有致癌性”( 组别2B) [2]。越来越多的研究对光敏感结构利尿剂的肿瘤相关性进行了验证。临床应用时,患者应采取遮蔽等方式来进行防护。
3. 2 β肾上腺素受体阻滞剂
β 受体活化后可以通过促进血管表皮生长因子( VEGF) 的表达,加速血管生成,有利于肿瘤细胞的生长、转移[3]。因此,抑制β 受体活化可能产生肿瘤抑制的效果。根据一项临床回顾性队列研究[4],β 受体阻滞剂确实可降低乳腺癌的致死率,降低复发和转移风险,但生存率并没有受到影响。
3. 3 CCB
部分观察性临床研究提示,CCB 可能与肿瘤发生相关。对此,ROTSHILD 等[5]纳入10 项临床研究进行了荟萃分析,对上述结论进行了验证。CCB 用药人群肺癌风险轻微增加[风险比( RR) = 1. 15,95% 置信区间( 95% CI) = 1. 01 ~ 1. 32]。进一步研究发现,CCB 用药人群的肺癌发生率随用药时间延长而增加( < 5 年: RR = 1. 12,95% CI = 1. 04 ~ 1. 20; 5 ~ 10 年:RR = 1. 22,95% CI = 1. 07 ~ 1. 40; > 10 年: RR =1. 33,95%CI = 0. 90 ~ 1. 96; P < 0. 001) 。
另一方面,CCB 类降压药硝苯地平也具有光敏感结构,可能与皮肤肿瘤发生相关。在FRIEDMAN等[1]的研究中,硝苯地平用药人群的唇癌发病率为对照组的2. 5 倍。
3. 4 ACEI
血管紧张素Ⅱ与受体结合后,促进炎性反应以及血管生成,可能与肿瘤风险相关。用ACEI 降低血管紧张素的生成,是否可降低肿瘤发生风险尚需临床验证。动物研究显示,低剂量的ACEI 培哚普利即可抑制小鼠头颈癌的肿瘤生长及血管新生[6]。但临床观察结果却不能为ACEI 与肿瘤风险提供明确依据。在LEVER 等[7]的研究中,长期服用ACEI 如卡托普利、依那普利的患者出现乳腺癌和肺癌的比例较低。而其他研究并没有重现这个结果[8]。PRONTERA 等[9]也证明,卡托普利抑制大鼠纤维肉瘤的生长及血管新生是通过与纤溶酶原激活物的结合,对血管生成抑制因子产生影响,并非ACEI 类药物共有的作用机制。
3. 5 ARB
研究发现,AT1R 和AT2R 的表达在正常组织和癌变组织中存在差异,其活化程度可能与血管内皮细胞生长因子水平或血管生成相关,提示RAS 系统可能参与了细胞增殖、血管生成等肿瘤进展过程[10]。2010年SIPAHI 等[11]纳入5 项临床试验进行荟萃分析,发现服用ARB( 主要包括氯沙坦、坎地沙坦、替米沙坦)的患者出现新生肿瘤比例略高于对照组( 7. 2% vs6. 0%,RR = 1. 08,95% CI = 1. 01 ~ 1. 15; P = 0. 016) 。将实体瘤按类型进行分析,前列腺癌和乳腺癌的发病率差异无统计学意义,但ARB 用药人群肺癌发病率略高于对照组( 1. 0% vs 0. 8%,RR = 1. 50,95% CI =0. 93 ~ 2. 41,P = 0. 097) ,肿瘤致死率差异无统计学意义。缬沙坦和厄贝沙坦则未见肿瘤相关性。
随后,FDA 指出其分析存在局限性[12],因此收集了多个ARB 上市申请时的临床数据,共纳入31 个临床试验,针对肿瘤相关风险进行了荟萃分析,并没有发现ARB 对肿瘤发生或肿瘤致死率的影响( RR =0. 99,95% CI = 0. 92 ~ 1. 06) 。同时,CHANG 等[13]也收集了台湾地区ARB 用药人群的肿瘤发生数据,对用药人群、用药方式等进行了限定。这项病例对照研究也没能验证ARB 的肿瘤风险( 26. 3% vs 26. 0%,RR = 0. 98,95% CI = 0. 85 ~ 1. 14) ,反而随着ARB 类药物暴露量和用药时间的延长,肿瘤发生率有降低的趋势。按单个药物进行分析,氯沙坦( RR = 0. 78,95%CI = 0. 63 ~ 0. 97) 有减少癌症风险的倾向,替米沙坦( RR = 1. 54,95% CI = 0. 97 ~ 2. 43) 和坎地沙坦( RR = 1. 79,95% CI = 1. 05 ~ 3. 06) 可能增加癌症风险,但增幅接近口服避孕药和激素,且肿瘤致死率并没有增加。因此,高血压患者并不需要排斥ARB 的使用。正确使用ARB,心血管系统的预期获益可能远远超过了可能带来的癌症风险。
4 讨论
非临床致癌性试验通过对正常啮齿类动物进行全生命周期给药,或对转基因动物进行6 个月给药,可判断肿瘤发生与给药的相关性。但是,啮齿动物致癌性研究结果可能不能完全反映人的致癌性风险。首先,实验结果可能存在误判,如动物在肿瘤发生前死于其他原因,诊断标准是否遵循病理损伤诊断标准和命名的国际协调( INHAND) ,相关肿瘤类型是否存在合并统计等。此外,啮齿类动物与人存在种属差异,如药物代谢和药理学作用与人体内不完全相似,啮齿动物特异性肿瘤与人体并不相关等。
临床回顾性分析在提示用药风险方面也存在局限性: ①试验结果的分析建立在同行分析或公开发表论文等数据的基础上,对于受试者的基础疾病、用药背景等基本信息无法逐一进行分层,解除对结果的干扰; ②试验的最初设计并非观察肿瘤相关事件,受试者用药时间、终点指标等各不相同,个体数据可能缺少可比性; ③分析时存在试验选择、样本量、统计方法等差异,可能得出相互矛盾的结论。此外,同类药物作为整体组别来研究,可能抵消个体药物的风险,单个药物的研究也不能代表该类药物的作用效果。降压药的临床肿瘤风险还依赖更科学的试验设计和更大样本量的分析来得出结论。
动物实验体系与人体内环境虽然存在差异,但致癌性实验设计较临床研究的荟萃分析更标准化,可排除个体因素的干扰,较直接地反映药物剂量与肿瘤风险的整体相关性。对于工业界和监管机构来说,动物的全生命周期给药致癌性实验结果仍然是提示人用药物致癌性的金指标。采用证据权重法,可充分解读非临床致癌性实验结果,以评价人的致癌风险。临床研究随着样本量的增加和数据的完善,可对降压药的肿瘤相关性进行验证。同时,也应结合适应证,思考临床治疗的风险获益比,在把握风险的基础上进行科学用药。
参考文献:
[1] FRIEDMAN G D,ASGARI M M,WARTON E M,et al. Antihypertensive drugs and lip cancer in non - Hispanic whites[J]. ArchIntern Med,2012,172( 16) : 1246 - 1251.
[2] KUNISADA M,MASAKI T,ONO R,et al. Hydrochlorothiazide enhances UVA - induced DNA damage[J]. Photochem Photobiol,2013,89( 3) : 649 - 654.
[3] THAKER P H,HAN L Y,KAMAT A A,et al. Chronic stress promotes tumor growth and angiogenesis in a mouse model of ovarian carcinoma[J]. Nat Med,2006,12( 8) : 939 - 944.
[4] WANG T,LI Y,LU H L,et al. β - Adrenergic receptors: New target in breast cancer[J]. Asian Pac J Cancer Prev,2015,16( 18) : 8031 - 8039.
[5] ROTSHILD V,AZOULAY L,ZARIFEH M,et al. The risk for lung cancer incidence with calcium channel blockers: A systematic review and meta - analysis of observational studies[J]. Drug Safe,2018,41( 6) : 555 - 564.
[6] YASUMATSU,R,NAKASHIMA T,MASUDA M,et al. Effects of the angiotensin - I converting enzyme inhibitor perindopril on tumor growth and angiogenesis in head and neck squamous cell carcinoma cells[J]. J Cancer Res Clin Oncol,2004,130( 10) : 567 - 573.
[7] LEVER A,HOLE D I,GILLIS C R,et al. Do inhibitors of angiotensin- I - converting enzyme protect against risk of cancer? [J].Lancet,1998,352( 9123) : 179 - 184.
[8] LI C L,MALONE K E,WEISS N S,et al. Relation between use of antihypertensive medications and risk of breast carcinoma among women ages 65 - 79 years[J]. Cancer 2003,98 ( 7 ) : 1504 -1513.
[9] PRONTERA C,MARIANI B,ROSSI C,et al. Inhibition of gelatinase A ( MMP - 2 ) by batimastat and captopril reduces tumor growth and lung metastases in mice bearing Lewis lung carcinoma[J]. Int J Cancer,1999,81( 5) : 761 - 766.
[10] DESHAYES F,NAHMIAS C. Angiotensin receptors: a new role in cancer? [J]. Trends Endocrinol Metab,2005,16( 7) : 293 - 299.
[11] SIPAHI I,DEBANNE S M,ROWLAND D Y,et al. Angiotensin -receptor blockade and risk of cancer: meta - analysis of randomized controlled trials[J]. Lancet Oncol,2010,11( 7) : 627 - 636.
[12] LINK W T,DE FELICE A. An FDA overview of rodent carcinogenicity studies of angiotensin II AT - 1 receptor blockers: Pulmonary adenomas and carcinomas[J]. Regul Toxicol Pharmacol,2014,70( 2) : 555 - 563.
[13] CHANG C H,LIN J W,WU L C,et al. Angiotensin receptor blockade and risk of cancer in type 2 diabetes mellitus: a nationwide case - control study[J]. J Clin Oncol,2011,29 ( 22 ) : 3001 -3007.