抗体药物偶联物抗药抗体中和活性分析研究进展
药审要点 |抗体药物偶联物抗药抗体中和活性分析研究进展
文章来源:中国新药杂志2019年第28卷第21期: 2573-2580
抗体药物偶联物抗药抗体中和活性分析研究进展
宫新江1,满素勤 2,3,邵 雪1,赵小平2,3,李 华2,3, 朱 晰 2,3 ,王海学1
(1 国家药品监督管理局药品审评中心2 国家上海新药安全评价研究中心3 上海益诺思生物技术股份有限公司)
[摘要] 抗体药物偶联物( ADCs) 是由单克隆抗体、连接子和小分子细胞毒素构成的多结构域分子。ADCs 通过单克隆抗体特异性地结合肿瘤细胞表面高表达的靶抗原,经抗原介导的内化作用进入细胞并释放细胞毒素,可提高疗效并降低细胞毒素对正常组织、细胞的毒性。与常规单克隆抗体一样,ADCs作为蛋白药物,具有免疫原性。此外,由于偶联引入了新的抗原表位,ADCs药物有可能诱导机体产生更为复杂的免疫反应,从而可能影响药物的有效性和安全性。对ADCs诱导的抗药抗体( ADA) 进一步表征,尤其是中和活性试验,有助于分析和预测因 ADA 的产生而可能导致的对有效性和安全性的影响。由于ADCs药物结构和作用机理的特殊性,针对不同结构域而产生的ADA均可能具有中和活性,通过多种机制阻断ADCs药物内化,或阻碍细胞毒素分子释放,从而降低细胞杀伤效应或导致脱靶毒性。因此,ADCs药物的中和抗体检测方法的设计和开发不同于常规抗体类药物,且具有较大的挑战。本文简述了ADCs药物免疫原性分析中中和活性检测方法及目前存在的挑战,以期对该领域的相关研究提供借鉴和参考。
[关键词] 抗体药物偶联物; 免疫原性; 抗药抗体; 中和抗体
抗体药物偶联物 ( antibody-drug conjugates, ADCs) 是一类新兴的抗癌治疗药物,此类药物借助单克隆抗体的特异性,靶向运送细胞毒素到肿瘤部位,不仅可以提高化学治疗的疗效,而且可以降低或消除细胞毒素分子对非靶组织、非靶细胞的毒性[1-2]。ADCs 药物是由单克隆抗体(monoclonal antibody, mAb) 、连接子( linker) 和小分子细胞毒素(cytotoxin)构成的多结构域分子[1]。单克隆抗体(mAb)可以特异地结合到肿瘤细胞表面的靶抗原,而 ADCs 药物通过 mAb 识别受体介导的内化作用进入肿瘤细胞,随后释放细胞毒素发挥细胞杀伤作用,见图 1。
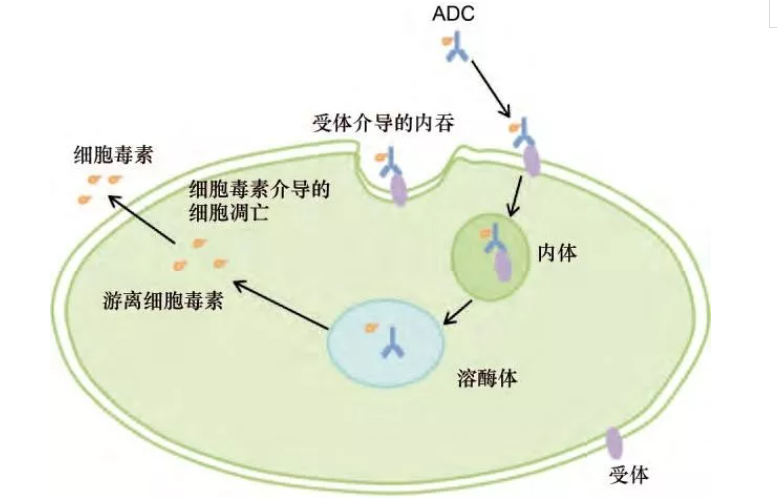
图 1 ADCs 药物作用机制图
免疫原性( immunogenicity) 是治疗性蛋白产品诱导机体产生免疫应答( 针对治疗性蛋白本身或其相关蛋白 ) 或诱导临床相关免疫不良反应的特性[4]。治疗性蛋白类药物诱导机体产生的免疫反应可能影响药物代谢动力学、药效动力学、药物安全性和有效性[4]。一般通过检测体液免疫产生的抗药抗体( anti-drug antibody,ADA) 评价大分子药物的免疫原性。对于不同的产品,ADA 的产生可能不会引起明显的临床后果,也可能导致严重的不良事件,如过敏反应、与内源性蛋白交叉反应、中和内源性蛋白导致其功能丧失等[4-5]。
中和抗体(neutralizing antibody,NAb) 是一种特殊的ADA,NAb 通过阻断产品到达其靶标或干扰受体 / 配体结合,从而干扰药物的体内活性[4-5]。因此,NAb 作为抗药抗体的一个子集,构成免疫原性研究和评价的重要部分。
ADCs 药物的单克隆抗体、连接子、连接子-细胞毒素分子、偶联引入的新的抗原表位均可能具有免疫原性,这使得 ADCs 药物诱导机体产生的免疫反应较为复杂; ADCs 药物结构和作用机制的特殊性决定了 NAb 的检测及评价也与抗体类药物具有不同之处,面临更大的困难和挑战。本文简述了ADCs药物的免疫原性风险,并重点阐述 ADCs 药物的中和抗体评价的方法及研究中面临的挑战。
1 ADCs 药物免疫原性风险评估和评价策略
1. 1 ADCs 药物免疫原性风险评估
大分子治疗性药物免疫原性的产生与药物自身特点以及受试者或患者自身免疫状态、疾病相关的因素等都密切相关[5]。ADCs 药物独特的结构特点,增加了其免疫原性风险的复杂性,不仅单抗作为抗原可引起免疫反应,连接子、连接子-细胞毒素均可作为半抗原引起免疫反应[6]。细胞毒素通过连接子与单克隆抗体的偶联可能导致新的免疫表位的产生,增加 ADCs 药物的免疫反应风险[7]。细胞毒 素呈疏水性,而单克隆抗体为亲水性,两者的偶联增加了药物聚合的可能性,也提高了 ADCs 药物引起免疫反应的风险[1-9]。因“表位扩展”( epitope sprea ding) 效应的存在,针对某表位的免疫反应可能扩展到同一分子的其他表位,ADCs 药物的多免疫原性表位可能导致其免疫反应形式复杂化或免疫程度增强[6]。ADCs 药物中连接子-细胞毒素的存在,可能促进抗连接子-细胞毒素的抗体介导的免疫复合物交联,形成的大分子复合物影响 ADCs 药物内化[10]。
免疫细胞、内皮细胞、肝血窦、肾血窦等细胞表面的甘露糖受体可识别单克隆抗体被糖基化修饰的部分,可能引起 ADCs 药物导致的脱靶性的细胞毒性发生[11]。ADCs 药物的 ADA 可能通过 Fcγ 受体介导非靶向组织内免疫复合物的形成和内化,从而导致细胞毒性的增加[2]。非靶组织细胞介导的含ADA、细胞毒性药物的免疫复合物的内化作用可导致脱靶性的细胞毒性产生,引起正常细胞的死亡[6,9]。ADCs 药物的细胞毒素可能来源于天然产物或与天然产物结构相似,存在预存抗体的受试者或患者给药后机体免疫系统被再次激发,导致ADA 的爆发性产生,从而严重影响药物的代谢动力学、疗效以及用药安全性[12]。
ADCs 药物没有对应的内源性成分,所以针对 ADC 药物的免疫反应不会中和重要的内源性蛋白[13-14]。鉴于有限的临床研究经验和 ADCs 药物分子的特殊性,将 ADCs 药物认定为具有中度免疫原性风险的大分子药物[6,9]。
1.2 ADC 药物免疫原性评价策略
治疗性蛋白药物的免疫原性评价多为定性或半定量的试验,通常采用多层次的分析策略[4-5,15]。第1 步为筛选试验,确定潜在的阳性样本。第 2 步为确证试验,确认抗体的药物特异性。确证试验一般在筛选试验的基础上,加入过量的药物竞争性结合 ADA,通过响应信号的降低确证抗体的特异性。第3步为通过滴度试验、中和活性试验、抗体分型 /亚型试验、表位分析( 结构域分析) 或亲和力检测等试验确定 ADA 的滴度、中和活性、亚型、表位和亲和力等特点,以便根据抗体的特点更好地分析可能出现异常的药动学、药效降低、过敏等不良反应事件发生等情况。
ADCs 药物作为特殊的生物大分子,其免疫原性评价同样遵循上述策略。鉴于 ADCs 药物的结构特点,推荐增加表位分析试验,评价针对单克隆抗体、连接子、连接子-药物等不同表位 ADA 的产生及其影响[10]。目前,桥连试验基本可以检测绝大多数类型的 ADA,因此基于桥连的酶联免疫试验 ( ELISA) 或电化学发光试验( ECL) 多用于大分子药物 ADA 的分析[4]。经 FDA 和 EMA 批准上市的Kadcyla 以及在研的 cantuzumab mertansine,MEDI-47等 ADCs 药物也采用基于桥连的ELISA或ECL方式进行免疫原性评价[10,16-19]。ADCs 药物的抗药抗体表位分析可采用竞争法或直接检测的方法[10,17]。竞争法表位分析的原理与确证试验类似,也是采用过量未标记的 ADCs与样本预先孵育,再进行检测[6,9-10]。直接检测法则选用 ADCs作为捕获试剂,靶向单克隆抗体或细胞毒素分子的抗体作为检测试剂,直接检测 ADA 的表型[17]。ADCs 药物免疫原性评价分析流程图见图 2。

图 2 常规 ADCs 药物免疫原性分析流程图
2 ADCs 药物抗药抗体中和活性分析研究方法
中和活性检测方法的分析模式的选择需要基于多种因素进行考虑,包括但不限于药物本身的作用机制、检测方法与体内真实情况的相关性、方法本身的选择性、生物基质的干扰程度、灵敏度和稳健程度等。对分析模式进行选择时,建议将测定方法与药物体内作用机制的相关性作为首要考虑因素。常规用于抗体类药物中和抗体分析的试验模式( format)分别为: 基于细胞的生物学试验( cell based assay) 、非细胞的竞争性配体结合试验(non-cell competitive ligand-binding assay,CLBA) 。试验模式的选择应该考虑药物的作用机制( mechanism of action,MOA) ,试验的灵敏度、选择性、精密度、药物耐受性及产生的 NAb 对受试者的影响等因素[4-5]。中和抗体检测方法开发的目的是检测临床相关的 NAb,检测性能是试验模式选择的关键因素。若已选择的试验假阴性 / 假阳性率较高且与临床结果一致性较差,应考虑提高方法的性能;若因技术限制无法达到预期的标准,则可以考虑选择性能更好的试验模式[20]。
2.1 基于细胞的生物活性试验
ADCs 所采用的效应细胞毒分子分为抑制有丝分裂的细胞毒素和促进DNA裂解的细胞毒素两类。美登素类似物DM1和DM4,auisatin 类似物 MMAE和 MMAF 等细胞毒素通过干扰细胞周期中微管蛋白的生成,抑制细胞的有丝分裂; calicheamicins类似物、pyrrolobenzodiazepine 类似物则通过与DNA的小沟结合诱导 DNA损伤,进而直接杀伤细胞或诱导细胞凋亡[2,21-22]。部分 ADCs 药物也可以通过抗体依赖的细胞毒性 ( ADCC ) 和补体依赖的细胞毒性( CDC) 发挥作用[23-24]。ADCs 药物的单克隆抗体和细胞毒素等不同结构域按照一定的顺序参与细胞杀伤效应,靶向单克隆抗体或细胞毒素的 NAb 可能阻断 ADCs 药物的细胞杀伤活性,因此单独采用细胞增殖、凋亡等细胞功能性试验,可较好地反映 ADCs 药物的作用机制,用于评价 ADCs 药物产生ADA 的中和活性[14]。鉴于 ADCs 药物的作用机制,FDA,EMA 等监管机构首推基于细胞的生物活性试验用于 ADCs 药物的中和抗体分析[4-5]。
2.1.1 以细胞酶促反应为基础的细胞试验
细胞增殖过程中代谢酶活性增加,而 ADCs 药物作用后细胞死亡或凋亡,酶活性降低。首先,根据 ADCs 药物的作用机制,选择合适的细胞系、检测系统,进而建立细胞活性、毒性检测系统,即药物的活性曲线。然后,根据药物的活性曲线,确定适当的 ADCs 药物浓度,样本中存在的 NAb 可以降低 ADCs 介导的细胞活性或增殖抑制。最后,根据一定浓度ADCs药物作用后细胞活性的改变,判定 NAb 存在与否。
以活细胞线粒体脱氢酶为基础的细胞试验:CCK8,WST-8,MTT,XTT,MTS 等试剂可以被活细胞线粒体脱氢酶还原为有颜色的甲臜,甲臜的吸光度值与活细胞的数量成正比,可以采用商品化的试剂盒分析细胞的增殖或凋亡,建立抗ADCs药物抗体的中和活性分析方法。Promega公司推出的CellTiter96 Non-Radioactive Cell Proliferation Assay( MTT) ,Cell-Titer 96 AQueous One Solution Cell Proliferation As-say ( MTS ) ,CellTiter 96 AQueous Non-Radioactive Cell Proliferation Assay ( MTS) ,同仁化学生产 Cell count kit-8 等检测试剂盒均可作为显色试剂用于以检测活细胞数量为基础的抗 ADCs 药物抗体的中和活性分析。
以蛋白水解酶等为基础的细胞试验: 细胞中的蛋白水解酶、烟酰胺腺嘌呤二核苷酸( NADH) 等可用于定量分析活细胞、凋亡或死亡细胞,进而用于评价抗 ADCs 药物抗体中和活性。多肽底物 Gly-Phe-AFC(Gly-Phe-7-Amino-4-trifluoromethylcoumarin)可通过细胞膜,活细胞中蛋白水解酶可催化该底物产生可检测的荧光信号,根据此原理利用 Flurescent Cell Viability Assay 试剂盒检测活细胞的数量,进而评价药物的活性。CytoTox-FluorTM Cytotoxicity Assay或 The CytoTox-GloTM Assay 根据细胞死亡后释放蛋白水解酶,催化细胞非通透性底物 bis-AAF-R110 (bis-alanyl-alanyl-phenylanlanyl-rhodamine110)或 AAF-aminoluciferin 产生可检测的信号,通过释放的蛋白水解酶的催化活力评价药物的毒性。活细胞的还原酶可将刃天青还原为可检测的荧光信号,荧光信号与细胞数量呈正比,CellTiter-Blue Cell Viability Assay则利用该原理评价 ADCs 药物的活性。
2.1.2 以细胞代谢标志物作为检测指标的细胞试验
细胞代谢的标志物,如三磷酸腺苷( ATP) 、乳酸脱氢酶( LDH) 等的浓度变化可作为检测指标用于评价细胞的活性[25-27]。以细胞代谢物为检测指标的 ADCs 药物活性分析方法,检测用药后代谢标志物水平的降低,降低程度与药物浓度呈正相关。样本中 NAb 与 ADCs 的结合导致 ADCs 药物活性降低,药物活性降低又引起代谢标志物水平的增加,增加程度与 NAb 的活性或浓度呈正相关。
IMGN853( mirvetuximab soravtansine) 用于治疗叶酸受体 α阳性且铂类耐药的卵巢癌患者,该药物的临床试验采用CellTiter-Glo Luminescent Cell Vi-ability Assay 试剂盒定量检测 ATP,评价抗药抗体的中和活性[28]。CytoTox ONETM ,CytoTox96 Non-Radioactive Cytotoxicity Assay,LDH-GloTM Cytotoxicity Assay 等试剂盒可定量检测细胞死亡后释放的LDH,评价药物导致的细胞凋亡。5-溴-2'-脱氧鸟苷可作为活细胞增殖过程中 DNA 合成的原料,因此定量检测活细胞中5-溴-2'-脱氧鸟苷的水平可用于评价细胞增殖。Caspase-Glo 3 /7 Assay System 可用于检测 Caspase 3 和 7 的活性来评价细胞的凋亡情况。MultiTox-Fluor Multiplex Cytotoxicity Assay,Mul-tiTox-Glo Multiplex Cytotoxicity Assay 等试剂盒基于常规的细胞用量可同时检测不同的细胞代谢物,应用此类试剂可降低结果的假阳性或假阴性。
2.2 竞争性配体结合试验( CLBA)
基于细胞的中和抗体分析试验,通过 ADCs 药物生物学活性被抑制评价抗药抗体的中和活性,比 CLBA 试验更能反映 ADCs 药物体内发挥作用的情形。但细胞试验受基质或药物干扰较大,试验的灵敏度较低; 样本的酸解处理可能会影响细胞的活性,因此在一些情况下,如经过充分的论证,也可考虑采用 CLBA 进行 ADCs 抗药抗体中和活性分析[4-5]。CLBA 是基于 NAb 与药物靶蛋白竞争性结合药物,若样本中含有NAb,则表现为药物与靶蛋白的结合被一定程度抑制。Finco 等[29]的研究显示,CLBA 试验系统通常较基于细胞的试验系统有更高的灵敏度、精密度,良好的药物耐受,还可耐受较强的基质干扰。
目前经 FDA 和 EMA 批准上市的 Adcetris 和 Kadcyla 以及部分处于临床研究的 ADCs 药物,分别以 ADCs 药物或 BSA 偶联的细胞毒素分子包被酶标板或电化学发光板,采用桥连等方式检测抗 ADCs 药物或抗细胞毒素分子的抗体,评价抗药抗体的免疫原性[17-18,30-32] 。借鉴上述 ADCs 药物 ADA 的分析方法,采用 ADCs 药物或细胞毒素分子包被反应板,随后应用标记的抗原或抗细胞毒素分子抗体进行竞争性结合,从而评价 ADA 的中和活性,并检测抗药中和抗体识别的表位。
3 ADCs 药物抗药抗体中和抗体分析的挑战
ADCs 药物中和抗体试验方法的开发存在的挑战包括: 基于细胞的抗体难以区分抗体的表位、难以选择合适的阳性对照抗体、细胞系的变异较大、基质中的药物干扰较大等[33-35]。
3.1 基于细胞的中和活性分析
基于细胞的中和抗体分析试验,一般选择对药物较为敏感且能够耐受较高基质干扰的细胞系。但细胞经多次传代后,可能会丢失基因或改变基因型,研究人员应考察细胞系稳定的传代次数,降低试验的变异性[36-37]。针对基质干扰,可在方法开发时确定最小稀释倍数,通过对样本的稀释,消除或降低基质的干扰。FDA 推荐的最小稀释倍数为 5 ~ 100 倍,过大的稀释倍数可能导致假阴性结果的出现[4]。
ADA 可能包含靶向单克隆抗体、连接子、连接子-药物、新表位的中和抗体,而靶向不同表位的中和抗体可引起不同的细胞反应(图 3) 。针对单克隆抗体的 NAb 可阻断 ADCs 药物与靶抗原的结合,导致受体介导的内化失败[10],表现为相较于药物对照组细胞活性升高。针对细胞毒素或连接子-细胞毒素的 NAb 内化进入靶细胞后,可能在溶酶体的特殊环境中被酸化、酶催化而释放细胞毒素,不影响细胞毒素发挥作用,表现为相较于药物对照组药物活性无改变[10,14]。存在相反的情况,即针对细胞毒素或连接子-细胞毒素的中和抗体以免疫复合物的形式被内吞、进入溶酶体后仍可结合于细胞毒素分子上,从而抑制细胞毒素的杀伤效应,表现为相较于药物对照组细胞活性升高,与第一种情况相似。NAb 具有结合游离细胞毒素和 ADCs 药物各功能域的能力,导致非靶组织因发挥免疫复合物清除功能摄取免疫复合物而中毒[6,14]。因此,基于细胞的抗 ADCs 药物中和活性分析不能检测到所有类型的中和抗体,可能低估中和抗体的存在。
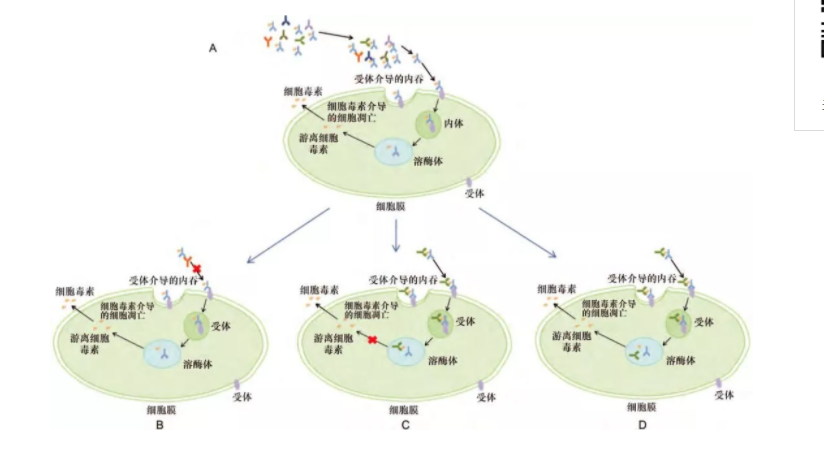
A: 正常的 ADCs 药物作用过程; B: 靶向单克隆抗体的抗药中和抗体阻断药物与靶点的结合,导致内化失败,细胞毒素无法发挥细胞杀伤效应; C、D: 靶向细胞毒素的抗药中和抗体,免疫复合物被细胞内化后,细胞毒素被单抗释放但仍与抗药中和抗体结合导致细胞毒素的杀伤效应被阻断( C) ,或抗药中和抗体被分解后释放出的细胞毒素发挥正常的杀伤效应(D) 。此处未显示靶向连接子-细胞毒素或靶向单独连接子的 NAb 可能产生与靶向细胞毒素分子的 2 种结果
图 3 抗药中和抗体对 ADCs 药物作用机制的阻断作用结果
3. 2 阳性对照抗体的选择
中和抗体检测结果高度依赖于试验的灵敏度和特异性,高灵敏度、特异性、选择性的试验方法则高度依赖于阳性对照抗体的选择[15,34]。来源于抗药中和抗体阳性受试者的抗体是阳性对照抗体的最佳选择,但是获得足够的此类阳性对照抗体非常困难,因此分析方法开发和验证过程中使用的阳性对照抗体多数来源于实验动物,如兔、小鼠等[34]。目前,多采用药物免疫试验动物,获得抗独特型的多克隆抗体或单克隆抗体作为阳性对照抗体。同一种试验方法,采用较高亲和力的阳性对照抗体可获得较高的灵敏度、相对较好的选择性和特异性[15]。ADCs 药物为多结构域药物,各结构域均可能引起机体的免疫反应。制备针对 ADCs 整个药物或单抗的阳性对照抗体较为容易,而制备针对细胞毒素小分子、连接子-细胞毒素分子等半抗原的具有中和活性、高亲和力的阳性对照抗体则存在较大挑战。此外,ADCs药物在连接后可能形成新的免疫原性表位,由于缺乏对这类表位的了解,因而制备针对此类抗原抗体的难度很大。鉴于此,几乎不可能实现表位特异的抗药抗体中和活性分析。
由于阳性对照抗体来源于动物,所以真实样本的中和抗体谱与阳性对照抗体存在差异,阳性对照抗体的中和活性并不能代表真实的 NAb 中和活性。因此,采用阳性对照抗体建立的试验方法的灵敏度、耐药性等参数仅能作为参考。
3.3 药物或靶点干扰
机体循环系统中往往既含有游离药物、游离ADA,又含有药物-ADA 免疫复合物。基质中游离药物对免疫原性检测往往产生干扰,而 ADA-药物免疫复合物的存在则导致 NAb 漏检率增加[35]。长期、多次给药后,样本中通常存在高浓度的游离药物或药物-ADA 免疫复合物,导致假阴性率明显增加。由于阳性对照抗体的性质、试验设计、药物浓度等因素都对试验方法的耐药性存在一定影响,因此不可能确定多种因素下的药物耐受水平[35]。通过在消除相采集样本或酸解处理样本,在某种程度上可增加检测的准确性和提高药物耐受水平[37-38]。但 ADCs 药物给药后样本酸解处理需注意下列问题[13]:采用酸敏感连接子制备的 ADCs 不能进行酸解处理。方法中采用的阳性对照抗体和样本中真实 NAb 的酸敏感性不同,检测的不确定性增加。经酸解、中和后的样本溶液,可能会改变细胞培养基的渗透压或 pH,不利于细胞生存,继而导致非药物作用的细胞死亡,使试验结果的假阳性率增加。
基质中可能存在的游离靶点可与 NAb 竞争性结合药物,发挥与中和抗体相同的降低药物活性的作用。个体基质中的游离靶点可因不同季节,受试者或患者患病状态、年龄、性别等因素有较大水平的波动,因此方法学验证时应考虑游离靶点对确定临界值产生的干扰。同理,样本检测中也应考虑样本中不同浓度的游离靶点可能导致假阳性率增加。此时,可考虑增加样本处理步骤,清除基质中游离靶点,降低或清除靶点干扰。
3.4 关键试剂
ADCs药物的细胞毒素分子可能来源于天然存在的物质或是与天然产物结构相似,因此未经 ADCs 药物治疗的个体基质中可能存在靶向此类分子的天然中和性抗体[12]。天然存在的抗药中和抗体使临界值偏移,继而对判断样本的检测结果造成不利影响。临界值验证过程中空白个体的选择需慎重考虑这个问题,可根据药物的特性、作用机制、所选空白个体的疾病状态等多种因素综合考虑。
CLBA 试验采用靶蛋白与 NAb 竞争性结合药物的原理对中和抗体进行分析评价。靶蛋白的纯度以及与内源性蛋白性质的相似性是影响试验参数的重要因素。基于检测原理及样本处理的需要,对 ADCs 药物进行生物素、Sulfo-tag 等标记时需考虑下列问题[9-10]:标记位点被连接子占据致使标记效率低或标记失败。标记导致 ADCs 的聚合倾向性增加,降低 ADCs 的稳定性和免疫学活性。高比率的标记可能掩盖 ADA 和 NAb 的识别表位。
此外,ADCs 药物主要用于癌症患者的治疗,不同癌症患者基础免疫水平不同,导致未给药患者与健康人样本中免疫因子有很大差异,并且患者对药物的免疫应答程度也会不同,应确认基于健康人群建立的抗药抗体中和活性分析方法对不同疾病状态下患者样本检测的适用性[39]。ADA 和 NAb 的检出率与试验方法、样本的处理、采集时间、伴随治疗药物特性、受试者或患者疾病状态等众多因素相关。因此,在仿制药评价时,不能直接对比 2 种药物 ADA 或 NAb 发生率,应对比仿制药与原研药的特性,建立一套分析方法进行 NAb 的分析[40]。最后,已上市 ADCs 药物较少,经验缺失也是一个大的挑战。
4 结语和展望
ADCs 药物因其高特异性的靶向治疗受到越来越多的关注。随着 ADCs 药物的增多,积累的 ADCs 药物免疫原性评价的经验可用于评估采用同样连接子、细胞毒素分子和同样药物-抗体比率连接的 ADCs 药物的临床免疫原性风险,判读 ADA 和 NAb 产生的趋势以及预测 ADA 和 NAb 识别的表位。同时也应认识到,每种 ADCs 药物的免疫原性风险与其采用的单克隆抗体、连接子、细胞毒素及其裂解方式、受试者免疫状态等因素有很大关系,单个 ADCs 药物的免疫原性评价方法和结果仅作为该类药物免疫原性检测方法设计和开发时的借鉴,尚不能为其他 ADCs 药物免疫原性风险评估策略的制定提供直接参考。因此,必须评估每种 ADCs 药物的免疫原性风险,加强对检测方法的开发和优化,指导药物研发,增加用药安全性。此外,ADCs 药物靶向运送细胞毒素的特性,启发新的结合性靶向治疗大分子的产生,如靶向传染性病原体的抗体-抗生素结合物[41]、靶向炎症的抗体-糖皮质激素结合物[42]等, 这也将为 ADCs 药物免疫原性评价带来新的挑战。
参 考 文 献
[1] CHARI RV,MILLER ML,WIDDISON WC. Antibody-drug con-jugates: an emerging concept in cancer therapy[J]. Angew Chem Int Ed Engl,2014,53( 15) : 3796 - 3827.
[2] DE GOEIJ BE,LAMBERT JM. New developments for antibody-drug conjugate-based therapeutic approaches[J]. Curr Opin Im-munol,2016,40: 14 - 23.
[3] PEREZ HL,CARDARELLI PM,DESHPANDE S,et al. Anti-body-drug conjugates: current status and future directions[J].Drug Discov Today,2014,19( 7) : 869 - 881.
[4] FDA. Guidance for industry,Immunogenicity Testing of Ther-apeutic Protein Products-Developing and Validating Assays forAnti-Drug Antibody Detection [EB / OL]. ( 2019 ) . https: / /www.fda.gov / ucm / groups / fdagov-public / @ fdagov-drugs-gen /documents / document / ucm629728. pdf.
[5]EMA.Guideline on Immunogenicity assessment of therapeutic proteins[EB / OL]. 2017. https: / / www. ema. europa. eu / en / doc-uments / scientific-guideline / guideline-immunogenicity-assess-ment-therapeutic-proteins-revision-1_en. pdf.
[6]HOCK MB,THUDIUM KE,CARRASCO-TRIGUERO M,et al. Immunogenicity of antibody drug conjugates: bioanalytical meth-ods and monitoring strategy for a novel therapeutic modality[J]. AAPS J,2015,17( 1) : 35 - 43.
[7]JAWA V,COUSENS LP,AWWAD M,et al. T-cell dependent immunogenicity of protein therapeutics: Preclinical assessment and mitigation[J]. Clin Immunol,2013,149( 3) : 534 - 555.
[8]HOLLANDER I,KUNZ A,HAMANN PR. Selection of Reaction Additives Used in the Preparation of Monomeric Antibody-Cali-cheamicin Conjugates[J]. Bioconjug Chem,2008,19 ( 1 ) : 358 - 361.
[9]CARRASCO-TRIGUERO M. Insights on the immunogenicity of antibody-drug conjugates [J]. Bioanalysis, 2015, 7 ( 13 ) :1565 - 1568.
[10]HOOFRING SA, HOCK MB,KALIYAPERUMAL A, et al.Im-munogenicity testing strategy and bioanalytical assays for antibody-drug conjugates[J].Bioanalysis,2013,5( 9) : 1041 - 1055.
[11]GOROVITS B,KRINOS-FIOROTTI C. Proposed mechanism of off-target toxicity for antibody-drug conjugates driven by mannose receptor uptake[J]. Cancer Immunol Immunother,2013,62 (2) : 217 - 223.
[12] GOROVITS B,CLEMENTS-EGAN A,BIRCHLER M,et al. Pre-existing Antibody: Biotherapeutic Modality-Based Review[J]. AAPS J,2016,18( 2) : 311 - 320.
[13]FIOROTTI CK. Immunogenicity considerations for antibody-drug conjugatesa focus on neutralizing antibody assays[J]. Bioanalys-is,2018,10( 2) : 65 - 70.
[14] GOROVITS B,WAKSHULL E,PILLUTLA R,et al.Recom-mendations for the characterization of immunogenicity response to multiple domain biotherapeutics[J. J Immunol Methods,2014,408: 1- 12.
[15]SHANKAR G,DEVANARAYAN V,AMARAVADI L,et al.Recommendations for the validation of immunoassays used for de-tection of host antibodies against biotechnology products[J]. J Pharm Biomed Anal,2008,48( 5) : 1267 - 1281.
[16]BEERAM M,KROP IE,BURRIS HA,et al. A phase 1 study of weekly dosing of trastuzumab emtansine ( T-DM1 ) in patients with advanced human epidermal growth factor 2-positive breast cancer[J]. Cancer,2012,118( 23) : 5733 - 5740.
[17]TOLCHER AW,OCHOA L,HAMMOND LA,et al.Cantuzum-ab mertansine,a maytansinoid immunoconjugate directed to the CanAg antigen: a phase I,pharmacokinetic,and biologic correl-ative study[J]. J Clin Oncol,2003,21( 2) : 211 - 222.
[18] GALSKY MD,EISENBERGER M,MOORE-COOPER S,et al. Phase I trial of the prostate-specific membrane antigen-directed immunoconjugate MLN2704 in patients with progressive metastat-ic castration-resistant prostate cancer[J]. J Clin Oncol,2008, 26( 13) : 2147 - 2154.
[19]ANNUNZIATA CM,KOHN EC,LORUSSO P,et al. Phase 1, open-label study of MEDI-547 in patients with relapsed or refrac-tory solid tumors[J]. Invest New Drugs,2013,31( 1) : 77 - 84.
[20]WU B,CHUNG S,JIANG XR,et al. Strategies to Determine Assay Format for the Assessment of Neutralizing Antibody Re-sponses to Biotherapeutics[J]. AAPS J,2016,18 ( 6) : 1335 -1350.
[21]THOMAS A,TEICHER BA,HASSAN R. Antibody-drug conju-gates for cancer therapy[J]. Lancet Oncol,2016,17 ( 6 ) : e254 - e262.
[22]DUMONTET C,JORDAN MA.Microtubule-binding agents:a dynamic field of cancer therapeutics[J].Nat Rev Drug Discov,2010,9( 10) : 790- 803.
[23]OFLAZOGLU E,STONE IJ,GORDON KA,et al. Macrophages contribute to the antitumor activity of the anti-CD30 antibody SGN-30[J]. Blood,2007,110( 13) : 4370 - 4372.
[24]JUNTTILA TT,LI G,PARSONS K,et al. Trastuzumab-DM1(T-DM1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer[J]. Breast Cancer Res Treat,2011,128( 2) : 347-356.
[25]LOMAKINA GY,MODESTOVA YA,UGAROVA NN. Biolumi-nescence assay for cell viability[J]. Biochemistry ( Mosc ) ,2015,80( 6) : 701-713.
[26]KAJA S,PAYNE AJ,NAUMCHUK Y,et al. Quantification of lactate dehydrogenase for cell viability testing using cell lines and primary cultured astrocytes[J].Curr Protoc Toxicol,2017,72: 22621- 22261.
[27]ADAN A,KIRAZ Y,BARAN Y. Cell Proliferation and Cytotox-icity Assays[J]. Curr Pharm Biotechnol,2016,17 ( 14 ) : 1213 - 1221.
[28]LOEBRICH S,SHEN M,COHEN E,et al.Development and characterization of a neutralizing anti-idiotype antibody against mirvetuximab for analysis of clinical samples[J].AAPS J,2017,19( 4) : 1223 - 1234.
[29] FINCO D,BALTRUKONIS D,CLEMENTS-EGAN A,et al.Comparison of competitive ligand-binding assay and bioassay formats for the measurement of neutralizing antibodies to protein therapeutics[J]. J Pharm Biomed Anal,2011,54 ( 2 ) : 351 -358.
[30]LAPUSAN S,VIDRIALES MB,THOMAS X,et al. Phase I studies of AVE9633,an anti-CD33 antibody-maytansinoid conju-gate,in adult patients with relapsed / refractory acute myeloid leu-kemia[J]. Invest New Drugs,2012,30( 3) : 1121 - 1131.
[31]RODON J,GARRISON M,HAMMOND LA,et al. Cantuzumab mertansine in a three-times a week schedule: a phase I and phar-macokinetic study[J]. Cancer Chemother Pharmacol,2008,62( 5) : 911 - 919.
[32]YOUNES A,KIM S,ROMAGUERA J,et al. Phase I multidose-escalation study of the anti-CD19 maytansinoid immunoconjugate SAR3419 administered by intravenous infusion every 3 weeks to patients with relapsed / refractory B-cell lymphoma[J].J Clin Oncol,2012,30( 22) : 2776 - 2782.
[33] GUPTA S,INDELICATO SR,JETHWA V,et al. Recommendations for the design,optimization,and qualification of cell-based assays used for the detection of neutralizing antibody responses e-licited to biological therapeutics[J]. J Immunol Methods,2007,321( 1 - 2) : 1 - 18.
[34] JOLICOEUR P,TACEY RL. Development and validation of cell-based assays for the detection of neutralizing antibodies to drug products a practical approach[J].Bioanalysis,2012,4 ( 24 ) :2959 - 2970.
[35] GUPTA S,DEVANARAYAN V,FINCO D,et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics[J].J Pharm Biomed Anal,2011,55( 5) :878 - 888.
[36]LIU Y,MI Y,MUELLER T,et al.Multi-omic measurements of heterogeneity in HeLa cells across laboratories[J]. Nat Biotechnol,2019,37( 3) : 314 - 322.
[37] CHATTERJEE S,VASHISHTA L,WAICHALE VS,et al. Development and validation of a cell based assay for the detection of neutralizing antibodies against recombinant insulins[J]. J Immunol Methods,2018,452: 53 - 62.
[38] BARBOSA MD,GLEASON CR,PHILLIPS KR,et al. Addressing drug effects on cut point determination for an anti-drug anti-body assay[J]. J Immunol Methods,2012,384( 1 - 2) : 152 -156.
[39]DEVANARAYAN V,SMITH WC,BRUNELLE RL,et al. Recommendations for systematic statistical computation of immunoge-nicity cut points[J]. AAPS J,2017,19( 5) : 1487 - 1498.
[40]GOUTY D,CAI CC,CAI XY,et al. Recommendations for the development and validation of neutralizing antibody assays in support of biosimilar assessment[J]. AAPS J,2017,20( 1) : 25.
[41] YACOBY I,BENHAR I. Targeted anti bacterial therapy[J]. Infect Disord Drug Targets,2007,7( 3) : 221 - 229.
[42]GRAVERSEN JH,SVENDSEN P,DAGNAES-HANSEN F,et al.Targeting the hemoglobin scavenger receptor CD163 in macrophages highly increases the anti-inflammatory potency of dexametha-sone[J]. Mol Ther,2012,20( 8) : 1550 - 1558.