抗体类药物超敏反应研究进展
药审要点 |抗体类药物超敏反应研究进展
文章来源:中国新药杂志2019年第28卷第21期: 2651-2657
抗体类药物超敏反应研究进展
宫新江,邵 雪,张 旻,朱飞鹏,闫莉萍,于 冰,叶 旋,刘轶博,周植星,崔 岚,赵华琛,王庆利,王海学
( 国家药品监督管理局药品审评中心)
摘要:抗体类药物在临床应用中很可能导致不同类型的超敏反应( hypersensitivity reaction,HSR) 。在近期某些创新单抗或双功能抗体的非临床研究中,相关动物种属或人源化动物模型给予候选分子也常见非预期HSR,严重时可能对药效学、药动学和/或毒理学研究结果的解读和评价以及人体不良反应的预测造成干扰。探索 HSR发生的机制有助于科学分析非临床研究的结果,并对临床试验中人体用药风险的评估和相应的风险缓解策略的制定提供更有价值的参考信息。本文对抗体类药物导致的HSR类型、临床表现和诊断方法、可能的发生机制进行了综述,并对非临床研究中HSR相关标志物的检测方法和必要性进行了探讨,以供研究者和监管机构关注或参考。
关键词:抗体类药物; 超敏反应; 非临床研究; 临床试验; 机制
近年来,抗体类药物( 如单克隆抗体、多功能抗体、抗体类似物或含有抗体的组合物等) 已成为生物技术药物中最为活跃的领域。与小分子药物相比,抗体类药物分子量大且结构复杂,免疫原性和免疫毒性通常是影响该类药物研发的重要因素。尽管人源化和全人源抗体已成为候选分子的首选,但其免疫原性和免疫毒性并未完全消除,在某些患者中仍有可能导致非预期的免疫反应,如免疫应答增强,其中超敏反应(hypersensitivity reaction,HSR) 是常见的免疫应答增强反应并容易引发安全性问题[1-2]。这类分子对于非临床研究中的实验动物属于异源蛋白,有的还可能参与免疫调节,因此即使选择了与人亲缘关系较近的非人灵长类作为药理学相关动物,仍可能产生较高发生率的HSR,导致动物死亡或非计划解剖,干扰对药效学、药动学和 / 或毒理学研究结果的解释和对产品有效性、安全性的评价[3-6]。在这种情况下,通过动物实验预测人体用药风险可能面临更多的挑战和不确定性[4]。探索HSR的发生机制有助于科学分析非临床研究结果,并为评估人体用药风险和制定相应的风险缓解策略提供更有价值的参考信息[4]。本文对抗体类药物HSR类型、临床表现和诊断方法、可能的发生机制进行了综述,并以此为出发点对非临床研究中如何研究和评价抗体类药物HSR进行了调研,以供研究者和监管机构关注、讨论或参考。
1 抗体类药物 HSR 类型
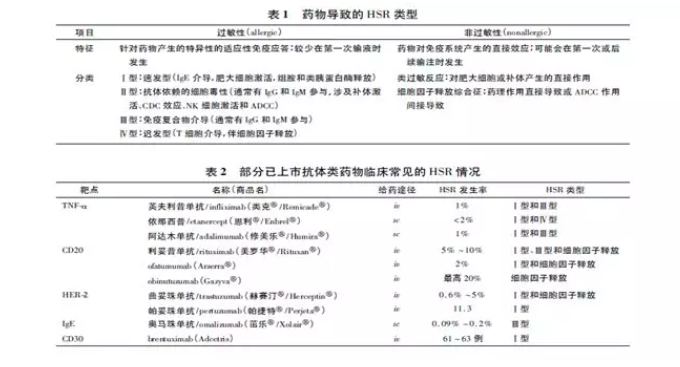
根据盖尔-库姆斯分类法(Gell-Coombs classifi-cation) ,药物引起的HSR通常分为Ⅰ,Ⅱ,Ⅲ 和Ⅳ型,其中Ⅰ型为 IgE 介导的急性反应,其余为亚急性或慢性反应[2,7]。但越来越多的研究表明很多急性反应的症状符合盖尔-库姆斯分类法,但不属于型反应,如类过敏(anaphylactoid)或假性过(pseudoallergic)[2]。此外,还可见混合型反应,表现为同时具有细胞因子释放和Ⅰ型HSR的特征,可见Ⅰ类胰蛋白酶和细胞因子IL-1,IL-6或 TNF-α等升高,或出现皮试阳性和/或特异性IgE抗体阳性[8]。某些单抗可能引起细胞因子释放综合征,通常表现为头疼、肌痛、恶心、腹泻、淋巴细胞减少和低血压等,并有可能导致严重不良反应,如在CD28超级激动剂TGN1412的Ⅰ期临床试验中,6例给予起始剂量( 0.1mg·kg- 1 ) 的健康志愿者因严重的细胞因子风暴而发生多器官衰竭[8-9]。该类型的细胞因子释放不同于混合型反应[8]。一项调查研究发现单抗类药物在人体中常见的不良反应为Ⅰ型(63%) 、混合型 (21%) 、细胞因子释放型 (13%) 和Ⅳ型(3% )[10],在动物实验中常见的为Ⅰ型和Ⅲ型[3]。表1和表2分别汇总了药物常见的HSR类型和部分已上市抗体类药物临床常见的HSR情况[3,9-11]。

2 抗体类药物 HSR 的临床表现、可能的机制和诊断方法
2.1 输液反应
2.1.1临床表现 抗体类药物引起的输液反应包括速发型反应( immediate reactions) 或迟发型反应(delayed reactions)[12]。速发型反应通常在给药后的最初几小时内出现[10,12],不同的抗体类药物引起的速发型输液反应在病因(etiology) 和症状( presen-tation) 方面具有较高的异质性,常表现为轻度至重度潮红、寒战、发热、心动过速、高血压、呼吸困难、恶心、呕吐及晕厥症状[10,13]。不同单抗引起该类型输液反应的发生率差异较大,如奥马珠单抗为 0. 09% ,曲妥珠单抗为40%而利妥昔单抗则为77%[13-14]。迟发型反应通常在给药后1~2h或14d前后出现,常见皮疹、血管炎、多形性红斑,较严重的症状包括 Stevens-Johnson综合征和中毒性表皮坏死松解症[10,12] 。
2.1.2可能的机制 IgE介导: 一般来讲,输液反应的出现需要一段时间的致敏过[13],但在利妥昔单抗、西妥昔单抗和托珠单抗等的使用过程中,部分患者在首次给药后即发生输液反应,皮试结果为阳性[14],且预先存在IgE抗体的患者在首次暴露于该单抗时更容易出现速发型HSR[15] 。有研究表明,西妥昔单抗所采用的表达系统为SP2/0细胞,其Fab结构域的糖型中含有非人来源的糖基化结构(如半乳糖-α-1,3-半乳糖,即α-gal抗原),有的患者体内预先存在针对α-gal抗原的IgE抗体,这部分患者在接受该单抗治疗后会发生较高比例的急性输液反应[16]。可能的机制为,单抗与特异性IgE结合后,通过与肥大细胞和嗜碱性细胞上的 FcεRI交联并激活后者,释放组胺、前列腺素、白三烯、类胰蛋白酶和血小板活化因子等[13]。
IgG参与: 特异性 IgG可通过FcγRIII与嗜碱性粒细胞、巨噬细胞或中性粒细胞结合,触发血小板活化因子(PAF) 的释放。当小鼠给予较高剂量的单抗且产生了IgG型抗性时较容易发生这种 IgE 非依赖型HSR[13-14]。由于需要致敏过程,通常在至少1次给药后发生,往往皮试结果为阴性。在英夫利昔单抗给药后出现 HSR 的患者中检测到了过敏原特异性IgG抗体[17] 。目前在人体中可观察到PAF水平与HSR的严重程度具有相关性[13]。在这种情况下一般检测不到类胰蛋白酶(tryptase),但可检测到血清组胺水平的升高[18]。与IgE介导的HSR类似,可观察到肥大细胞和嗜碱性粒细胞的激活。尚不明确是否有补体参与该途径[13]。
细胞因子释放相关: 某些输注反应是由不同类型的免疫细胞( 包括单核细胞或巨噬细胞、T细胞、B细胞和NK细胞)释放大量细胞因子造成的,这种急性期反应通常称为细胞因子释放综合征(CRS) ,常发生在第1次给药后的数小时,在临床表现上可能不易与Ⅰ型HSR区分[13]。体外和体内研究结果显示,TNF-α,IFN-γ,IL-8 和 IL-6 是引起 CRS 的主要原因[19]。不同结构和功能学特点的单抗引发细胞因子释放的机制各不相同,文献报道的可能机制包括[19-21]: 通过结合靶抗原直接激活效应细胞( 特别是 T 细胞) 或诱导靶抗原聚集( antigen clustering) 引起细胞因子释放,如 muromonab( αCD3) 和 TGN1412( αCD28) ; 与 FcγRs 结合激活效应细胞 ( 如 NK 细胞 、中性粒细胞和单核细胞等) 或表达 FcγRs 的细胞 ( 如内皮细胞和血小板等) ,通过多种机制释放细胞 因子,如alemtuzumab ( αCD52 ) 、利妥昔单抗 ( αCD20) 等。由于不同的抗体类药物在分子高级结构、抗原表位、与 FcγRs的亲和力和生物学功能方面的多样化以及患者免疫系统的复杂性和不同个体之间可能存在的多态性(如FcγIIIa) ,在人体中发生的CRS 可能是由多种机制共同参与的[20]。
免疫复合物( IC) 沉积: 迟发型输液反应主要为Ⅲ型HSR,通常继发于IC沉积,常常累及皮肤、肾脏和其他器官中的小血管,一般在药物暴露后5~7 d开始产生[3-4]。对于IgG 型抗体来讲,这是IgG介导产生HSR 的另一种途径。通过IgG 型抗体激活补体并形成大的免疫复合物,进一步诱导产生过敏毒素(anaphylatoxins,如C3a和C5a),导致肥大细胞释放炎性质。由于不同的IgG 亚类( subclass) 与FcγR 的亲和力不同,该过程依赖于IgG 亚类及其与FcγR 的亲和力。如英夫利昔单抗诱导产生的抗药抗体(ADA) 中存在较高比例的IgG4,该亚类的抗体激活补体的能力和与FcγR的亲和力均较低[14]。此外,免疫复合物的形成还取决于药物-ADA的比例、IC数量、大小、电荷以及抗原/抗体的亲和力等[4,21]。
其他: 某些抗体( 如利妥昔单抗、西妥昔单抗、英夫利昔单抗等) 可能会通过激活C3a 和C5a 而导致补体激活相关的假性过敏反应(complement activation-related pseudo allergy,CARPA) 的发生[2,13]。此外,某些抗体类药物中含有的辅料,如甘露醇(mannitol)、吐温80、乳胶(latex)、木瓜蛋白酶(papain,如abciximab)
和氨丁三醇(trometamol,如依那西普) 等可能引起HSR[12]。在阿达木单抗的说明书中特别提到了预充注射器或注射笔针头帽中的天然胶乳( natural rubber latex) 可能导致部分人群过敏[22]。
2.2 注射部位反应
注射部位反应可能是速发型的或在注射后1~2d 出现,之后常随着时间的推移逐渐减弱。临床表现为注射部位瘙痒、红斑和水肿,在某些患者中皮试结果为阳性[11-12]。通常认为注射部位反应是一种由T 细胞介导的HSR,其中CD8+T细胞为主要效应细胞,但也可能涉及其他机制[10,12]。
2.3 诊断方法
在FDA 关于治疗用蛋白产品免疫原性评价指导原则中[23],建议基于3 种标准作为HSR 诊断的依据,主要涉及皮肤和/或黏膜组织相关症状(如全身性荨麻疹、瘙痒或潮红、嘴唇-舌部悬雍垂肿胀) 的急性发作(几分钟至数小时) 、呼吸衰竭( 如呼吸困难、喘息、支气管痉挛、喘鸣、呼气峰流量减少、低氧血症) 、血压降低或终末器官功能障碍相关症状(如低血压、晕厥、失禁)和胃肠道症状(如腹部绞痛、呕吐) 等。目前,尚无灵敏且特异的实验室检测手段用于HSR的临床诊断。通过体外试验检测针对抗体类药物的IgE 水平、炎性介质释放( 如血浆或尿液中的组胺水平) 或嗜碱性粒细胞的激活情况有助于阐明潜在的病理生理学特征,并对可能的风险缓解策略的制定提供思路。如怀疑可能存在速发型输液反应时,有必要检测IgE; 对于IgG 的检测有助于解释可能发生的Ⅲ型HSR。此外,对于炎性介质的检测需特别关注基质的适用性和采样时间,如在IgE 介导的过敏反应中,人体血浆中组胺的峰值出现在给药后5~15 min,30~60 min 后便恢复至基线水平,尿液中组胺的水平则可维持更长时间。发生HSR时,应在发作后的30~120 min( 半衰期仅为2h) 内采集血样用于β-类胰蛋白酶(类胰蛋白酶的主要成分)检测,若其水平高于基础值则提示存在肥大细胞激活,应在至少2d后重复检测。值得注意的是,在某些情况下,即使类胰蛋白酶水平正常,但若嗜碱性粒细胞介质参与,也有可能发生HSR[8]。皮肤点刺试验(skin prick test) 、皮内试验( intradermal test) 和皮肤斑贴试验( patch test) 等体内试验有助于Ⅰ型HSR的诊断[8],由于阳性信号会随时间而减弱,因此检测时间越早越好。关于皮试试验,FDA在指导原则中提出应设置阳性对照和阴性对照,并描述具体的判定标准[24]。此外,已有研究表明嗜碱性粒细胞活性检测(BAT) 可用作单抗介导的速发型HSR的研究[11]。
3 探索HSR 发生机制的研究方法
3.1 一般考虑
探索HSR的发生机制有助于回顾性分析和解读动物实验结果。针对某一特定的抗体类药物,引起HSR的类型和机制可能各不相同。深入了解产品特征(如人源化程度、糖基化类型、表达系统、药理作用机制、给药方案等)和拟用人群(如疾病类型、免疫状态和合并用药情况) 是探索单抗HSR发生机制的前提[10,12-13]。在非临床研究中,理想情况下应选择药理作用相关且免疫反应特征与人体相似的动物种属用于安全性和有效性研究[25]; 对于因抗体类药物和/或动物原因( 如该种属对受试物易发生较强的免疫反应)出现HSR,并造成动物非预期死亡或因濒死而执行安乐死并干扰对安全性和有效性的评价时,建议进行回顾性调查研究以对该试验的临床预测价值进行评估[6]。
3.2 血清中抗药抗体( ADA) 的检测
在非临床研究和临床研究中,抗体类药物均有可能诱导适应性免疫应答和ADA的产生。影响免疫原性发生率和严重程度的因素包括产品、工艺和患者/疾病相关的因素[26]。在EMA 颁布的单抗类药物免疫原性指导原则中,对免疫原性的风险管理和ADA的检测提出了具体的建议[26]。对于ADA的检测可参考蛋白类药物免疫原性研究相关的指南并考虑产品特点和拟用目的,本文中不做详细阐述。在某些情况下,如单抗中含有非人源的糖基化结构(如半乳糖-α-1,3-半乳糖) ,有必要测定IgE以预测可能的速发型输注反应; 若在早期临床试验中出现首次给药后的过敏反应发生率较高,也推荐进行IgE检测[16,26]。根据调研,已有特异性针对猴IgE的商品化ELISA试剂盒(如供应商Alpha Diagnostics,货号7070) 。
3.3 循环免疫复合物(CIC) 的检测
通常循环中分子量较大的CIC会被单核-巨噬细胞系统(mononuclear phagocyte system,MPS) 清除,较小的则经肾脏排出体外[3],只有符合一定大小的CIC长期存在于循环中才有可能沉积于毛细血管基底膜并引起免疫复合物性疾病。由于非临床研究中的抗体类药物( 如单抗) 剂量通常较高( 常见50~300 mg·kg-1) ,对于容易产生ADA 的药物来讲,更容易产生IC[3]。与检测组织中的IC沉积相比,检测血清或血浆中的CIC相对简单。有多种方法可用于检测毒理试验猴血清中的CIC,但各方法的灵敏度和特异性均存在一定局限性,易产生假阳性和假阴性结果。因此,有必要采用不同方法的组合进行特异性检测[3,27-28]。根据调研,已有特异性针对人和不同实验动物种属CIC的商业化ELISA试剂盒( 如货号#002,Quidel,San Diego) 。一般情况下,给药后CIC 的增加可以为免疫原性提供间接证据; 但值得注意的是,某些情况下(如感染或药物聚集)也可能导致CIC增加,需结合CIC,ADA和/或组织IC沉积检测结果进行综合评价[3]。3.4 补体受体1( CR1) 的检测
在人类和许多非人灵长类动物中,红细胞表面存在的CR1能黏附CIC(主要为C3b和C4b),进一步运输至网状内皮系统( reticuloendothelial system,RES) 进行清除; 在啮齿类中,主要通过血小板上的因子H参与该过程[3,27]。可通过流式细胞术检测CR1表达情况,CR1的表达水平降低可能提示存在IC且与IC的清除率加快相关,尤其是当重复给药后产生HSR时[27]。
3.5 血浆补体的检测
补体系统的激活可导致大量免疫毒素C3a和末端补体复合物Cb5b-9 的产生,推荐采用EDTA-2K 抗凝的血浆进行检测[27]。目前已有商业化的用于检测C3a和C5b-9的ELISA试剂盒(如QuidelMicroVue C3a 和SC5b-9 Plus EIA) ,且其适用性已在食蟹猴上得到验证[4,27]; 还可使用总补体活性(CH50) 法测定对绵羊红细胞的裂解能力,以提示补体的激活情况[3,27]。
3.6 血清中炎性介质的检测
通过检测肥大细胞和嗜碱性粒细胞释放的组胺或其他炎性介质的水平有助于确定是否存在药物诱导的HSR或类过敏免疫反[27]。根据调研,已有检测组胺释放的ELISA试剂盒(目录号RE95000,IBL,Toronto,Canada) ; 也可以尝试采用流式细胞仪检测嗜碱性粒细胞或肥大细胞上的活化标志物,如CD63或CD203[27]。类胰蛋白酶在肥大细胞脱颗粒过程中发挥作用。正常情况下,α-胰蛋白酶和β-胰蛋白酶的水平低于11ng·mL-1 ( 可在过敏反应之前或在临床症状和症状消退后的24 h 或更多时间内获得血清胰蛋白酶的基线水平),急性过敏期间总胰蛋白酶比基线水平增加2倍或更高。尽管总胰蛋白酶水平的升高可支持过敏反应的诊断,但如未检测到升高也不能排除发生过敏反应的可能性。此外,在全身性肥大细胞增多的患者中也可检测到类胰蛋白酶升高[24]。
3.7 IC 沉积检查
一般情况下,已经形成的CIC会被RES清除;但在某些情况下,则沉积于肾小球、血管、滑膜组织、肺、肝、脉络丛等部位并激活补体、激肽、凝血/纤溶途径并诱发系统性促炎症反应[3]。血管壁和肾小球是常见的IC沉积位点,易引发血清病或免疫复合物型肾小球肾炎[4,21]。沉积的IC 成分包括抗体类药物及ADA ( IgG,IgM 和/或IgA) ,C3d 和C5b-9等,因此对于IC 沉积的检测需要考察上述成分的共定位,表现为药物、补体和ADA染色的增强[4]。选择免疫组化的试剂至关重要,尤其是用于检测IC中单抗的抗体需具有较高的特异性,避免与内源性免疫球蛋白(如IgG)结合。若待检组织来自啮齿类或犬,则该检测抗体较易实现;若待检组织来自猴,那么检测抗体需能特异性识别单抗而不与猴的内源性
IgG 有交叉反应。此外,电镜检查可见肾小球毛细血管基底膜致密层内和/或基底膜内皮细胞和上皮细胞下有中等至高电子密度的小丘状致密沉积物,为IC沉积提供形态学证据或对特异性较强的IC 进行定位[4]。其局限性在于通常只能对少量的组织进行详细检查,如结合免疫组化和光镜观察则评估更大范围的组织并做出更为准确的结论。
3.8 其他指标
凝血指标改变( 如PT 和APTT 延长,FIB 降低) 、血清白蛋白水平的降低,或三酰甘油升高等对肾小球疾病具有一定的预测价值; 血小板降低可能与活性胺的产生有关[4]。
4 对非临床研究中进行HSR 相关研究的思考
4.1 前瞻性试验设计的必要性
尽管单抗类药物在动物体内的免疫原性对于人体的预测价值有限,但因免疫原性而产生的HSR 在临床表现上存在相似之处,不同种属间的免疫反应提示的生物标志物具有一定的转化价值[25]。因此在非临床研究阶段进行相关的研究有助于在早期临床试验中对输液反应相关的风险进行监测。在进行非临床研究的试验设计时,除了动物本身的临床相关性外,科学的试验设计也是提高临床预测价值的关键因素[25]。应基于产品可能的体外和体内作用机制以及其他潜在的风险,前瞻性地对可能发生的HSR进行考察,针对性地监测相关指标的变化,以更准确地解释试验发现和提高临床预测价值[4,23,25]。良好设计的非临床研究有助于在早期临床试验中探索具有HSR提示意义的生物标志物,如补体(C3a,C-5b9) 、细胞因子( IL-6) 、凝血指标( APTT、TT 和血小板、白蛋白、抗凝血酶III等) 。此外,血药浓度的异常改变往往伴随着ADA 的产生,也可作为提示HSR发生的早期标志物[4]。对于具有免疫调节作用或其他较高风险的抗体类药物,严谨设计的细胞因子释放试验有助于预测可能的临床用药风险[19]。此外,深入了解产品的结构特征(如人源化程度、对天然氨基酸的突变、糖基化特点等) ,基于风险制定前瞻性非临床试验设计和评价策略显得尤为重要。
4.2 回顾性调查研究的意义
在抗体类药物重复给药的非临床研究中,常会遇到实验动物死亡或因达到安乐死条件而实施非计划解剖的情况。这类非预期死亡或非计划安乐死往往缺乏明确的剂量-效应关系,伴有毒代动力学和/或ADA检测结果以及肾脏、肝脏或肺脏等的组织病理学改变,初步提示与免疫反应具有相关性。此时,进行调查性的回顾研究有助于解释实验动物死亡的具体原因,阐明是否与药物的毒性直接相关,特别是通过对这种调查性研究结果的分析,有助于预测此类免疫反应在临床试验中出现的可能性,以及如何制定相关的风险控制计划。
4.3 提高非临床研究的预测价值
自TGN1412 事件以后,随着对该品种非临床研究资料的进一步审查和回顾性调查研究( 尤其是细胞因子释放检测方法) 的开展,对TGN1412在人体中产生细胞因子风暴的机制已有较为清晰的了解,同时业界和监管机构也进一步认识到通过非临床模型预测人体不良反应方面存在的一些局限性,并提出了一些具体的完善措施,如基于最低预期生物效应水平(MABEL)计算首次临床试验起始剂量、基于药物作用机制和风险评估单抗类药物的免疫原性风险等[19,26]。对于具有免疫调节作用的抗体类药物,需尤其关注药理作用和免疫相关的超敏反应因素,综合在药理学相关种属、人源化模型以及采用人全血或免疫细胞进行的体外和/或体内试验的研究结果提高对人体不良反应的预测价值和选择更为安全的剂量[29]。
4.4 与监管机构的沟通交流
如果能通过前瞻性研究或回顾性分析对免疫反应发生的机制进行探索,且有充足的理由判断是否具有临床相关性以及制定相应的临床风险缓解策略,那么基于该模型获得的研究结果,对于临床试验起始剂量的设计可能会起到关键的作用,反之对试验数据进行解读时需特别谨慎。此时,若非临床试验结果仍存在难以解释的毒性反应,建议研究者及时与监管机构进行沟通[4]。
5 结语
由于单抗药物在结构和功能方面的复杂性,可能会通过多种免疫相关或非免疫相关的机制诱导产生HSR,并对疗效和安全性的评估带来不利影响。近年来,随着许多新靶点、新结构和新作用机制的抗体类药物候选分子进入临床前或临床研究,由HSR引起的安全性担忧成为研究者和监管机构共同关心的问题。在对HSR 进行风险识别和评估时,应综合已有认识、单抗结构( 糖基化类型、生产过程中产生的杂质和其他质量属性) 、作用机制( 靶细胞性质、特异性抗体反应、免疫复合物的形成以及抗体的间接作用,如级联信号传导和细胞因子释放) 、临床因素、年龄因素和治疗史等相关因素,评估风险级别和非预期的临床后果。在非临床研究中,由于动物对抗体类药物的免疫反应与人体存在差异和/或所选择的动物个体之间缺少遗传多态性[9,25],有时并不能很好地预测人体HSR的发生、类型及其严重程度。尽管如此,已有较多研究机构报道转基因动物模型或非人灵长类模型,对于蛋白因修饰而产生的新抗原表位( neo-epitopes) 的预测、不同产品间相对免疫原性的评价( relative immunogenicity betweenproducts) 、免疫耐受的打破( breaking of tolerance) 、临床后果的预测等具有一定的价值[25]。FDA于2018年6月组织专门的workshop对如何通过优化动物模型提高肿瘤免疫治疗产品的临床预测价值进行了讨论,分享了很多有指导意义的观点[30]。因此,基于产品特点有针对性地设计试验,或针对已有的研究结果进行科学的分析和/或必要的调查研究,将是研究者面临的新挑战,同时也对监管机构如何基于风险评估原则进行科学审评带来了更多的挑战[25]。
参考文献
[1] PICARD M,GALVAO VR. Current Knowledge and management of hypersensitivity reactions to monoclonal antibodies[J]. J Allergy Clin Immunol Pract,2017,5( 3) : 600 - 609.
[2] F L P T,M SZ ROS T,KOZMA G,et al. Infusion reactions associated with the medical application of monoclonal antibodies: The role of complement activation and possibility of inhibition by factor H[J]. Antibodies,2018,7( 1) : 14 - 22.
[3] ROJKO JL,EVANS MG,PRICE SA,et al. Formation,clearance,deposition,pathogenicity,and identification of biopharmaceutical-related immune complexes: review and case studies[J].Toxicol Pathol,2014,42( 4) : 725 - 764.
[4] HEYEN JR,ROJKO J,EVANS M,et al. Characterization,biomarkers,and reversibility of a monoclonal antibody-induced immunecomplex disease in cynomolgus monkeys ( Macaca fascicularis)[J]. Toxicol Pathol,2014,42( 4) : 765 - 773.
[5] MALL C,SCKISEL GD,PROIA DA,et al. Repeated PD-1 /PD-L1 monoclonal antibody administration induces fatal xenogeneichypersensitivity reactions in a murine model of breast cance[J]. Oncoimmunology,2016,5( 2) : e1075114.
[6] HUSAR E,SOLONETS M,KUHLMANN O,et al. Hypersensitivityreactions to obinutuzumab in cynomolgus monkeys and relevance to humans[J]. Toxicol Pathol,2017,45( 5) : 676 - 686.
[7] RAJAN TV. The Gell-Coombs classification of hypersensitivity reactions: a re-interpretation[J]. Trends Immunol,2003,24( 7) : 376 - 379.
[8] CLARKE JB. Mechanisms of adverse drug reactions to biologics[J]. Handb Exp Pharmacol,2010( 196) : 453 - 474.
[9] WHRITENOUR J,CASINGHINO S,COLLINGE M,et al. Nonclinical tools to assess risk of drug hypersensitivity reactions[J].Annu Rev Pharmacol Toxicol,2016,56: 561 - 576.
[10] ISABWE GAC,GARCIA NM,VECILLAS SL,et al. Hypersensitivityreactions to therapeutic monoclonal antibodies: phenotypes and endotypes[J]. J Allergy Clin Immunol,2018,142 ( 1 ) :159 - 170 e152.
[11] SANTOS RB,GALVAO VR. Monoclonal antibodies hypersensitivity: prevalence and management[J]. Immunol Allergy Clin North Am,2017,37( 4) : 695 - 711.
[12] COROMINAS GG,LOBERA. Hypersensitivity reactions to biological drugs[J]. J Investig Allergol Clin Immunol,2014,24( 4) : 212 - 225.
[13] MAGGI E,VULTAGGIO A,MATUCCI A. Acute infusion reactions induced by monoclonal antibody therapy[J]. Expert Rev lin Immunol,2011,7( 1) : 55 - 63.
[14] VULTAGGIO A,MAGGI E,MATUCCI A. Immediate adverse eactions to biologicals: from pathogenic mechanisms to prophylactic anagement[J]. Curr Opin Allergy Clin Immunol,2011,11( 3) : 262 - 268.
[15] DELPHINE M,RADJ G, et al. Anti-cetuximab IgE ELISA for identification f patients at a high risk of cetuximab-induced anaphylaxis[J]. mAbs,2011,3( 4) : 396 - 401.
[16]DAGUET A,WATIER H. 2nd charles richet et jules héricourt orkshop therapeutic antibodies and anaphylaxis[J]. mAbs,2011,3( 5) : 417 - 421.
[17]SVENSON PG,SAXNE,et al. Monitoring patients treated with nti-TNF-a biopharmaceuticals: assessing serum infliximab and nti-infliximab antibodies[J]. Rheumatology,2007,46 ( 12 ) :1828 - 1834.
[18] CHEIFETZ A,SMEDLEY M,MARTIN S,et al. The incidence nd management of infusion reactions to infliximab: a large center xperience[J]. Am J Gastroenterol,2003,98( 6) : 1315 - 1324.
[19] VESSILLIER RT,EASTWOOD,et al. Cytokine release assays or the prediction of therapeutic mAb safety in first-in man trials-Whole blood cytokine release assays are poorly predictive for GN1412 cytokine storm[J]. J Immunol Methods,2015,424:43 - 52.
[20]GRIMALDI C,FINCO D,FORT MM,et al. Cytokine release: a orkshop proceedings on the state-of-the-science,current challenges nd future directions[J]. Cytokine,2016,85: 101 - 108.
[21]GONZALEZ ML,WAXMAN FJ. Glomerular deposition of immune omplexes made with IgG2a monoclonal antibodies[J]. J Immunol,2000,164( 2) : 1071 - 1077.
[22]FDA.Highlights of prescribing information,Humira( adalimumab) njection,for subcutaneous use[EB/OL]. ( 2018 ) . https:/ /www. accessdata. fda. gov /drugsatfda _ docs /label /2018 /125057s410lbl. pdf
[23]FDA.Immunogenicity Assessment for for Therapeutic ProteinProducts[EB/OL].(2014).https://www.fda.gov/downloads/drugs /guidances /ucm338856. pdf.
[24]FDA.Draft Guidance for Industry Immunogenicity Assessment forTherapeutic Protein Products[EB/OL].(2013).http://www.nihs.go.jp/dbcb/immunogenicity /FDA_2013_Immunogenicity%
20Assessment%20for%20Therapeutic%20Protein%20Products_Draft. pdf.
[25] BRINKS V,JISKOOT W,SCHELLEKENS H. Immunogenicity of therapeutic proteins: the use of animal models[J]. Pharm Res,2011,28( 10) : 2379 - 2385.
[26] EMA/CHMP. Guideline on immunogenicity assessment of monoclonal antibodies intended for in-vivo clinical use. pdf[EB/OL].( 2012) . http: / /www. ema. europa. eu /docs /en_GB/document_library /Scientific_guideline /2012 /06 /WC500128688. pdf.
[27] LEACH MW,ROTTMAN JB,HOCK MB,et al. Immunogenicity /hypersensitivity of biologics[J]. Toxicol Pathol,2014,42( 1) : 293 - 300.
[28] STUBENRAUCH K,WESSELS U,ESSIG U,et al. Evaluation of a generic immunoassay with drug tolerance to detect immune complexes in serum samples from cynomolgus monkeys after administration of human antibodies[J]. J Pharm Biomed Anal, 2010,52( 2) : 249 - 254.
[29]FRANK R. BRENNAN AK. Translational immunotoxicology of immunomodulatory monoclonal antibodies[J]. Drug Discov Today Technol,2016,21 - 22: 85 - 93.
[30]FDA.Non-clinical Models for Safety Assessment of Immuno-oncology Products[EB/OL].(2018-06).https://www.aacr.org/ AdvocacyPolicy/GovernmentAffairs/Documents/FDA%20AACR%20Nonclinical%
20Models%20SLIDES%20Compressed%20Webpage%202018%2009%2017.pd